题目内容
体积为1L的干燥容器中充入氨气,测得容器中气体对氢气的相对密度为9.7。用此气体进行喷泉实验,当喷泉停止后,进入容器中液体的体积约是( )
| A.0.2L | B.0.25L | C.0.75L | D.0.8L |
D
 ,则根据“十字交叉”法可得它们的物质的量关系为:
,则根据“十字交叉”法可得它们的物质的量关系为: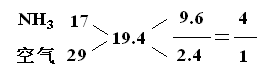
即可知,在1L容器中,进入容器中液体的体积约是0.8L;

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
题目内容
| A.0.2L | B.0.25L | C.0.75L | D.0.8L |
 ,则根据“十字交叉”法可得它们的物质的量关系为:
,则根据“十字交叉”法可得它们的物质的量关系为:

 目标测试系列答案
目标测试系列答案