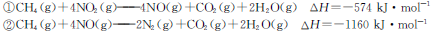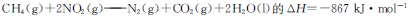题目内容
(10分)现正开始使用一种安全气袋以防止汽车撞车时在驾驶室的人因向前冲撞发生意外。这种气袋内装有一种能在高温下分解出气体的混合物。例如有一种配方为:
61%—68%NaN3(叠氮化钠)、0%—5%NaNO3、0%—5%陶土、23%—28%Fe2O3粉、1%—2%SiO2粉、2%—6%石墨纤维。这些粉末经加压成型后,装在一个大袋子里,袋子放在驾驶室座位前。撞车时,约在10毫秒(10-3秒)内引发下列反应: 2NaN3=2Na+3N2(365℃分解)反应在约30毫秒内完成,袋内充满N2气而胀大,阻止人体前冲。在以后的100~200毫秒内气体“ 消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。
消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。
(1)你认为完成上述引发分解、生成气体的“消失”、钠变成氧化钠过程各需上述配方 里哪些物质和起什么作用 。
里哪些物质和起什么作用 。
(2)若气袋内放300g NaN3,在充满氮气时,袋内气体体积为(1大气压,300K) L 。若袋内气体压力达到4大气压(此时为350K),则袋内气体体积为 L。
(3)配方中Fe2O3的量是如何控制的 。
(4)叠氮离子中有三个氮原子连成直线,N—N键等长(116pm)。写出其电子式 。
(5)怎样做到既使混合物在30毫秒内迅速分解,但又不燃烧、爆炸 。
61%—68%NaN3(叠氮化钠)、0%—5%NaNO3、0%—5%陶土、23%—28%Fe2O3粉、1%—2%SiO2粉、2%—6%石墨纤维。这些粉末经加压成型后,装在一个大袋子里,袋子放在驾驶室座位前。撞车时,约在10毫秒(10-3秒)内引发下列反应: 2NaN3=2Na+3N2(365℃分解)反应在约30毫秒内完成,袋内充满N2气而胀大,阻止人体前冲。在以后的100~200毫秒内气体“
 消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。
消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。(1)你认为完成上述引发分解、生成气体的“消失”、钠变成氧化钠过程各需上述配方
 里哪些物质和起什么作用 。
里哪些物质和起什么作用 。(2)若气袋内放300g NaN3,在充满氮气时,袋内气体体积为(1大气压,300K) L 。若袋内气体压力达到4大气压(此时为350K),则袋内气体体积为 L。
(3)配方中Fe2O3的量是如何控制的 。
(4)叠氮离子中有三个氮原子连成直线,N—N键等长(116pm)。写出其电子式 。
(5)怎样做到既使混合物在30毫秒内迅速分解,但又不燃烧、爆炸 。
(10分)(1) NaN3分解供产生N2 ,陶土、SiO2吸附N2,Fe2O3使Na 变为Na2O 。
(2)V=6.9×0.082×300=169.7(L)
V=6.9×0.082× 350/4 =49.5(L)
(3) 6Na+Fe2O3=2Fe+3Na2O
(4)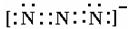 或
或
(5)原料粉碎、混匀、成型, 使反应快、扩散快,反应要足够快,使所释放的热“全”用于后续反应,而不使气袋明显升温。
使反应快、扩散快,反应要足够快,使所释放的热“全”用于后续反应,而不使气袋明显升温。
(2)V=6.9×0.082×300=169.7(L)
V=6.9×0.082× 350/4 =49.5(L)
(3) 6Na+Fe2O3=2Fe+3Na2O
(4)
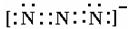 或
或
(5)原料粉碎、混匀、成型,
 使反应快、扩散快,反应要足够快,使所释放的热“全”用于后续反应,而不使气袋明显升温。
使反应快、扩散快,反应要足够快,使所释放的热“全”用于后续反应,而不使气袋明显升温。略

练习册系列答案
相关题目
 列4种方法中最好的是________(填“甲”“乙”“丙”或“丁”),理由是______________。
列4种方法中最好的是________(填“甲”“乙”“丙”或“丁”),理由是______________。