题目内容
【题目】根据如下能量关系示意图,下列说法正确的是
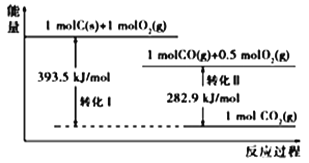
A. 1 molC(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ===2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ===2CO(g) ΔH= 221.2 kJmol1
D. CO的燃烧热ΔH=+282.9 kJmol1
【答案】C
【解析】
A、由图可知,1 mol C(s)与1 mol O2(g)的能量之和大于393.5 kJ,而1 mol C(g)与1 mol O2(g)的能量之和远大于393.5 kJ,选项A错误;B、由图可知,1 mol CO(g)与0.5mol O2(g)生成1 mol CO2(g)放出282.9 kJ的热量,所以反应2CO(g)+O2(g) =2CO2(g)中,生成物的总能量小于反应物的总能量,选项B错误;C、由图可知,1 mol C(s)与0.5mol O2(g)转化为1 mol CO(g),放出热量为:393.5-282.9=110.6 kJ,所以2C(s)+O2(g) ==2CO(g) ΔH= 221.2 kJmol1,选项C正确;D、根据选项B得反应CO(g)+![]() O2(g) =CO2(g) ΔH= 282.9 kJmol1,可知CO的燃烧热ΔH=-282.9 kJmol1,选项D错误。答案选C。
O2(g) =CO2(g) ΔH= 282.9 kJmol1,可知CO的燃烧热ΔH=-282.9 kJmol1,选项D错误。答案选C。

【题目】下列与胶体性质无关的是( )
A.河流入海口处形成沙洲
B.冶金厂常用高压电除去烟尘
C.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
D.在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀
【题目】A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
阳离子 | Na+、Al3+、Ba2+、NH4+ |
阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下①B溶液分别与C、D混合,均有白色沉淀生成②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体
回答下列问题:
(1)A所含的阳离子和C所含阳离子的半径大小____>______(填离子符号)。B所含的阴离子是________
(2)C溶液呈___性(填“酸性”或“碱性”),其原因是__________________
(用离子方程式解释)。D的化学式是____________
(3)以Pt为电极电解1L0.1mol/LB的水溶液,当电路中通过0.1mol电子时,
溶液的pH为_______(设电解过程溶液体积不变),阳极的电极反应式为 _____
(4)若将④阳极产生的气体通入A溶液中至恰好完全反应时,则溶液中各离子
浓度由大到小的排列顺序为__________________________