题目内容
根据方程式Zn+H2SO4=ZnSO4+H2↑,判断其中被还原的元素是
H
H
,被氧化的元素是Zn
Zn
,氧化剂是H2SO4
H2SO4
,还原剂是Zn
Zn
,氧化产物是ZnSO4
ZnSO4
,还原产物是H2
H2
.分析:反应Zn+H2SO4=ZnSO4+H2↑中,Zn元素化合价升高,被氧化,为还原剂,H元素化合价降低,被还原,H2SO4为氧化剂,结合元素化合价的变化判断相关概念.
解答:解:反应Zn+H2SO4=ZnSO4+H2↑中,H元素化合价降低,被还原,H2SO4为氧化剂,H2为还原产物,Zn元素化合价升高,被氧化,为还原剂,ZnSO4为氧化产物.
故答案为:H;Zn;H2SO4;Zn;ZnSO4;H2.
故答案为:H;Zn;H2SO4;Zn;ZnSO4;H2.
点评:本题考查氧化还原反应,侧重于学生的分析能力和基本概念的理解和运用的考查,为高频考点,注意从元素化合价的角度认识相关概念和物质的性质,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
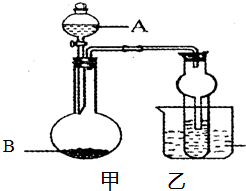 某同学设计如图所示的装置进行实验,请回答:
某同学设计如图所示的装置进行实验,请回答:(1)若试管内盛溴的四氯化碳溶液,液体A跟固体B(电石)在常温下反应,产生的气体可以使溴的四氯化碳溶液褪色,则A可能是
(2)若A为一种酸(HA)溶液,B为碳酸钠固体,试管内盛澄清的苯酚钠溶液,实验过程中观察到试管内溶液变浑浊,再加热烧杯中的水至70℃以上,观察到试管中的现象是
(3)本装置在不加热的条件下除制取乙炔外,还可以进行多种气体的制取和性质实验.请填写编号⑤栏目中的物质的名称或化学式(要求可制得的气体与示例的气体不同,而且设计要合理).
| 编号 | 液体A | 固体B | 可制得的气体 |
| ① | 浓氨水 | NaOH | NH3 |
| ② | 稀硫酸 | Zn | H2 |
| ③ | 稀盐酸 | CaC03 | C02 |
| ④ | 双氧水 | Mn02 | Q |
| ⑤ |