题目内容
能源是人类生存和发展的重要支柱.研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义.已知下列热化学方程式①2H2(g)+O2(g)=2H2O(l)△H=-570kJ/mol;
②H2(g)+
| 1 |
| 2 |
③C(s)+
| 1 |
| 2 |
④C(s)+O2(g)=CO2(g)△H=-393.5kJ/moL;
⑤CO2(g)+2H2O(g)=2CH4(g)+2O2(g)△H=+890kJ/moL
回答下列问题
(1)H2的燃烧热为
(2)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然难直接测定,但可通过间接的方法求得.已知C(s)+H2O(g)=H2(g)+CO(g)△H=akJ/moL;
则a=
(3)事实证明,能设计成原电池的反应通常是放热反应.
①下列化学反应在理论上可以设计成原电池的是
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.2H2(g)+O2(g)=2H2O(l)△H<0
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
②以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为
(4)有同学利用CuSO4溶液,进行以下实验探究.
①图一是根据反应Zn+CuSO4=Cu+ZnSO4 设计成的锌铜原电池.
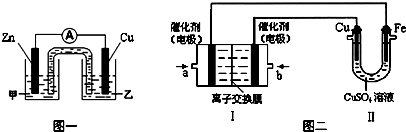
电解质溶液乙是
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是
分析:(1)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,根据燃烧热的概念来判断;
(2)根据方程式②、③运用盖斯定律求得反应热;根据气体的熵大于固体的熵;根据△G=△H-T△S,△G<0自发进行判断;
(3)构成原电池的条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,能自发的进行氧化还原反应时,该反应必须是放热反应,据此分析判断;氢氧燃料电池工作时,负极发生氧化反应,正极发生还原反应;
(4)甲中电极为Zn,为负极,则Cu为正极,铜离子得到电子;实现铁上镀铜,Cu为阳极,则b为正极,a为负极,甲烷失去电子;
(2)根据方程式②、③运用盖斯定律求得反应热;根据气体的熵大于固体的熵;根据△G=△H-T△S,△G<0自发进行判断;
(3)构成原电池的条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,能自发的进行氧化还原反应时,该反应必须是放热反应,据此分析判断;氢氧燃料电池工作时,负极发生氧化反应,正极发生还原反应;
(4)甲中电极为Zn,为负极,则Cu为正极,铜离子得到电子;实现铁上镀铜,Cu为阳极,则b为正极,a为负极,甲烷失去电子;
解答:解:(1)因燃烧热在某一温度和压强下lmol某物质B完全燃烧生成稳定化合物时所释放出的热量,由①可得H2的燃烧热为285.8kJ?mol-1,
故答案为:285.8kJ?mol-1;
(2)因③-②可得:C(s)+H2O(g)=H2(g)+CO (g)△H=+131.5kJ?mol-1,气体的熵大于固体的熵,所以熵变大于0,自由能△G=△H-T△S,当△G<0时可自发进行,该反应△H,>0,△S>0,满足△G<0,需高温,故答案为:+131.5;>;高温时;
(3)①能设计成原电池的反应通常是放热反应,且必须是能自发进行的氧化还原反应,
A.该反应是吸热反应,所以不能设计成原电池,故不选;
B.该反应是放热反应且能自发的进行氧化还原反应,所以能设计成原电池,故选;
C.该反应为中和反应,不是氧化还原反应,所以不能设计成原电池,故不选;
故答案为:B;
②以KOH溶液为电解质溶液的氢氧燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
(4)①甲中电极为Zn,为负极,电解质溶液甲是ZnSO4,则Cu为正极,铜离子得到电子,电解质溶液乙是CuSO4,电极反应为Cu-2e-=Cu2+,
故答案为:CuSO4;Cu-2e-=Cu2+;
②实现铁上镀铜,Cu为阳极,则b为正极,通入的气体O2,a为负极,甲烷失去电子,电极反应为CH4-8e-+10OH-=CO32-+7H2O,
故答案为:O2;CH4-8e-+10OH-=CO32-+7H2O;
故答案为:285.8kJ?mol-1;
(2)因③-②可得:C(s)+H2O(g)=H2(g)+CO (g)△H=+131.5kJ?mol-1,气体的熵大于固体的熵,所以熵变大于0,自由能△G=△H-T△S,当△G<0时可自发进行,该反应△H,>0,△S>0,满足△G<0,需高温,故答案为:+131.5;>;高温时;
(3)①能设计成原电池的反应通常是放热反应,且必须是能自发进行的氧化还原反应,
A.该反应是吸热反应,所以不能设计成原电池,故不选;
B.该反应是放热反应且能自发的进行氧化还原反应,所以能设计成原电池,故选;
C.该反应为中和反应,不是氧化还原反应,所以不能设计成原电池,故不选;
故答案为:B;
②以KOH溶液为电解质溶液的氢氧燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
(4)①甲中电极为Zn,为负极,电解质溶液甲是ZnSO4,则Cu为正极,铜离子得到电子,电解质溶液乙是CuSO4,电极反应为Cu-2e-=Cu2+,
故答案为:CuSO4;Cu-2e-=Cu2+;
②实现铁上镀铜,Cu为阳极,则b为正极,通入的气体O2,a为负极,甲烷失去电子,电极反应为CH4-8e-+10OH-=CO32-+7H2O,
故答案为:O2;CH4-8e-+10OH-=CO32-+7H2O;
点评:本题考查燃烧热的定义、盖斯定律的运用、原电池、电解池的原理,明确原电池的构成条件及反应必须是放热反应是解(3)的关键,(4)电化学的综合运用是该题的难点,题目难度中等.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
 能源是人类生存和发展的重要支柱.研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义.
能源是人类生存和发展的重要支柱.研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义.