题目内容
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g) +H2O(g)=CO(g) +3H2(g) △H>0,在一定条件下,向体积为1L的密闭容器中充入1 mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是
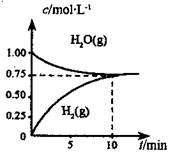

| A.达平衡时,CH4( g)的转化率为75% |
| B.0~10 min 内,v(CO)=0.075 mol?L-1·min-1 |
| C.该反应的化学平衡常数K=0.1875 mol?L-1 |
| D.当CH4(g)的消耗速率与H2O(g)的生成速率相等,反应到达平衡 |
D
试题分析:根据图像可知,反应进行到10min时达到平衡状态,氢气和水蒸气的平衡浓度均是0.75mol/L,因此消耗水蒸气的浓度是1mol/L-0.75mol/L=0.25mol/L,则:
CH4(g) +H2O(g)=CO(g) +3H2(g)
起始浓度(mol/L) 1 1 0 0
转化浓度(mol/L) 0.25 0.25 0.25 0.75
平衡浓度(mol/L) 0.75 0.75 0.25 0.75
所以达平衡时,CH4(g)的转化率为
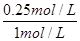 ×100%=25%,A不正确;
×100%=25%,A不正确;0~10 min 内,v(CO)=
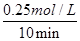 =0.025 mol?L-1·min-1,B不正确;
=0.025 mol?L-1·min-1,B不正确;该反应的化学平衡常数K=
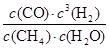 =
= =0.1875 mol2?L-2,C不正确;
=0.1875 mol2?L-2,C不正确;CH4(g)的消耗速率与H2O(g)的生成速率方向相反,因此当二者相等时,反应达到平衡状态,D正确,答案选D。

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
 B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空: C(g)+D(g)的化学平衡常数和温度的关系如下:
C(g)+D(g)的化学平衡常数和温度的关系如下: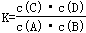
 Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
 W (s) + 3H2O (g) 请回答下列问题:
W (s) + 3H2O (g) 请回答下列问题: WI4 (g)。下列说法正确的有__________。
WI4 (g)。下列说法正确的有__________。 2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是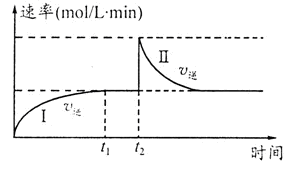
 2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
2SO3(g),2min末测得容器中有7.2mol SO2。试回答: B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: x C(g) + 2D(g),容器里的压强逐渐降低,经5s后保持不变。在此5s内C的平均反应速率为0.1 mol·L-1·s-1。则下列的说法中正确的是
x C(g) + 2D(g),容器里的压强逐渐降低,经5s后保持不变。在此5s内C的平均反应速率为0.1 mol·L-1·s-1。则下列的说法中正确的是 CO(g)+H2O(g)
CO(g)+H2O(g)

 CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1