题目内容
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g) W (s) + 3H2O (g) 请回答下列问题:
W (s) + 3H2O (g) 请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率_________;该反应的平衡常数表达式K=___________
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为 ____(填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)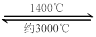 WI4 (g)。下列说法正确的有__________。
WI4 (g)。下列说法正确的有__________。
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
WO3 (s) + 3H2 (g)
 W (s) + 3H2O (g) 请回答下列问题:
W (s) + 3H2O (g) 请回答下列问题:(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率_________;该反应的平衡常数表达式K=___________
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为 ____(填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)
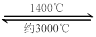 WI4 (g)。下列说法正确的有__________。
WI4 (g)。下列说法正确的有__________。A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
(1)0.3 mol/(L·min)或0.005 mol/(L·s)或1.8 mol/(L·h)(2分,单位不写扣1分)
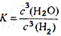 (1分)
(1分)(2)60%。(1分) 正反应吸热(1分)。
(3)C( 1分)
(4)BD( 2分,一对一错不给分、漏1个给1分)
试题分析:
(1)解:设氢气的物质的量为x
WO3 (s) + 3H2 (g)
 W (s) + 3H2O (g) ⊿m
W (s) + 3H2O (g) ⊿m3 48
x 4.8 x=0.3
V H2=0.3/0.5*2= 0.3 (mol/(L·min)) K=C3(H2O)/ C3(H2)
(2)解:设氢气的起始体积为a,变化体积为x
WO3 (s) + 3H2 (g)
 W (s) + 3H2O (g)
W (s) + 3H2O (g) 初: a 0
变: x x
平: a-x x
(a-x)/ x=2/3 x=3a/5 H2的平衡转化率为x/a*100%="3a/5/" a*100%=60%
随温度的升高,H2与水蒸气的体积比减小,正向进行,正反应为吸热反应。
(3)A、前后气体系数相等,“混合气体的总压强保持不变”不能作为平衡标志,错误;B、同向的,不是标志,错误C、因不都是气体,虽体积不变,“混合气体的密度保持不变”只在平衡时,可做标志,正确;D、M=m/n, m和n始终不变,不是标志,错误。
(4)A、温度升高,速率都加快,错误;B、正确;C、寿命降低,错误。D、可逆反应,I2可升华,正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 B(g)+C(g) △H ="+85.1" kJ· mol-1
B(g)+C(g) △H ="+85.1" kJ· mol-1

 Y(g)△H <0”,温度T1<T2的情形
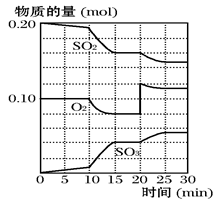
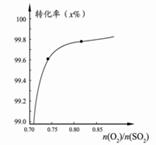
Y(g)△H <0”,温度T1<T2的情形 2SO3(g)转化关系(如图3)中,纵坐标表示O2的转化率
2SO3(g)转化关系(如图3)中,纵坐标表示O2的转化率 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。 Si3N4(s) + 6CO(g) + Q(Q>0)
Si3N4(s) + 6CO(g) + Q(Q>0)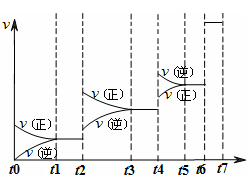
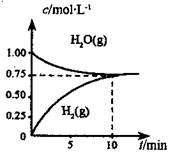
 CH3OCH3(g) +H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
CH3OCH3(g) +H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是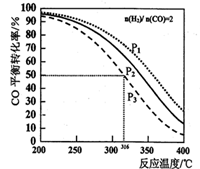
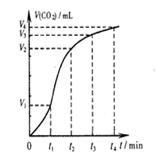
 2NH3(g) △H<0。在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,
2NH3(g) △H<0。在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,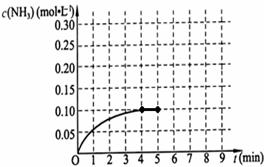
 2SO3(g) ΔH<0
2SO3(g) ΔH<0