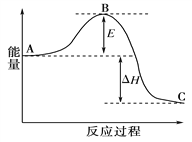
题目内容
【题目】已知水在25℃和100℃时,其电离平衡曲线如下图所示:
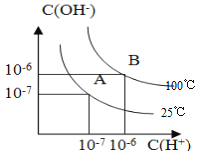
(1)25℃时,水的离子积为_________________
(2)若向25℃的水中滴加少量冰醋酸,c(H+)_____________(填“变大”、“变小”或“不变”),醋酸的电离方程式为________________________
(3)若向100℃的水中加入少量Ag2CrO4固体,一段时间后,达到Ag2CrO4的沉淀溶解平衡,该温度下溶度积的表达式Ksp (Ag2CrO4)=_____。
【答案】1.0×10-14 变大 CH3COOH![]() CH3COO-+H+ c2(Ag+)·c(CrO42-)
CH3COO-+H+ c2(Ag+)·c(CrO42-)
【解析】
(1)根据水的电离平衡可知,水电离产生的c(H+)= c(OH—),所以在25℃的曲线上,c(H+)= c(OH—)= 1.0×10-7mol/L,则水的离子积Kw= c(H+)×c(OH—)= 1.0×10-14;
(2)冰醋酸溶于水发生部分电离,生成的H+使溶液中的c(H+)增大;其电离方程式为CH3COOH![]() CH3COO— + H+;
CH3COO— + H+;
(3)由Ag2CrO4的沉淀溶解平衡Ag2CrO4(s)![]() 2Ag++CrO42-可得,Ksp (Ag2CrO4)= c2(Ag+)·c(CrO42-)。
2Ag++CrO42-可得,Ksp (Ag2CrO4)= c2(Ag+)·c(CrO42-)。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大