��Ŀ����
����Ŀ��As2O3��ҽҩ�����ӵ���������ҪӦ�ã�ij����Ԫ�أ�As���Ĺ�ҵ��ˮ����ͼ1����ת��Ϊ��As2O3 �� 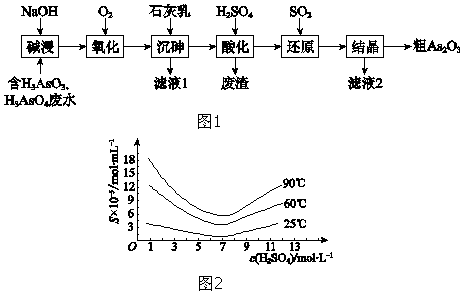
��1�����������Ŀ���ǽ���ˮ�е�H3AsO3��H3AsO4ת��Ϊ�Σ�H3AsO4ת��ΪNa3AsO4��Ӧ�Ļ�ѧ����ʽ�� ��
��2����������ʱ��1mol AsO33��ת��ΪAsO43��������ҪO2mol��
��3�������顱�ǽ���Ԫ��ת��ΪCa5��AsO4��3OH��������������Ҫ��Ӧ�У� a��Ca��OH��2��s��Ca2+��aq��+2OH����aq����H��0
b��5Ca2++OH��+3AsO43��Ca5��AsO4��3OH��H��0
�о������������顱������¶���85�森
�û�ѧƽ��ԭ�������¶ȸ���85������¶����߳������½���ԭ���� ��
��4������ԭ��������H3AsO4ת��ΪH3AsO3 �� ��Ӧ�Ļ�ѧ����ʽ�� ��
��5������ԭ���������Һ��H3AsO3�ֽ�ΪAs2O3 �� ͬʱ�ᾧ�õ���As2O3 �� As2O3�ڲ�ͬ�¶ȺͲ�ͬŨ�������е��ܽ�ȣ�S��������ͼ2��ʾ��Ϊ����ߴ�As2O3�ij����ʣ����ᾧ�����̽��еIJ����� ��
��6������˵���У���ȷ����������ĸ���� a����As2O3�к���CaSO4
b����ҵ�����У���Һ2��ѭ��ʹ�ã������Ļ�����
c��ͨ���ȡ����顱���ữ����˳���Դﵽ������Ԫ�ص�Ŀ�ģ�
���𰸡�
��1��H3AsO4+3NaOH�TNa3AsO4+3H2O
��2��0.5
��3���¶�����,��Ӧaƽ�������ƶ�,c��Ca2+���½�,��Ӧbƽ�������ƶ�,Ca5��AsO4��3OH�������½�
��4��H3AsO4+H2O+SO2�TH3AsO3+H2SO4
��5��������Ũ��ԼΪ7mol?L��1,��ȴ��25��,����
��6��abc
���������⣺��1��H3AsO4���������Ʒ�Ӧת��ΪNa3AsO4��Ӧ�Ļ�ѧ����ʽH3AsO4+3NaOH�TNa3AsO4+3H2O��
���Դ��ǣ�H3AsO4+3NaOH�TNa3AsO4+3H2O����2����������ʱ��AsO33��ת��ΪAsO43����AsԪ����+3�����ߵ�+5�ۣ�ת��2�����ӣ���1mol AsO33��ת��ΪAsO43��ת�Ƶ���2mol��������0�۽�����2�ۣ���Ҫ0.5mol��
���Դ��ǣ�0.5����3�������顱�ǽ���Ԫ��ת��ΪCa5��AsO4��3OH��������������Ҫ��Ӧ�У�a��Ca��OH��2��s��Ca2+��aq��+2OH����aq����H��0��b��5Ca2++OH��+3AsO43��Ca5��AsO4��3OH��H��0���¶����߸���85���Ӧaƽ�������ƶ���c��Ca2+���½�����Ӧbƽ�������ƶ���Ca5��AsO4��3OH�������½���
���Դ��ǣ��¶����ߣ���Ӧaƽ�������ƶ���c��Ca2+���½�����Ӧbƽ�������ƶ���Ca5��AsO4��3OH�������½�����4������ԭ�������ж�������H3AsO4��ԭΪH3AsO3�������������������ᣬ��ӦΪ��H3AsO4+H2O+SO2�TH3AsO3+H2SO4��
���Դ��ǣ�H3AsO4+H2O+SO2�TH3AsO3+H2SO4����5����ͼ2��֪������Ũ��ԼΪ7 molL��1��25��ʱAs2O3�ij�����������ڷ��룬��Ϊ����ߴ�As2O3�ij����ʣ�������Ũ��ԼΪ7 molL��1����ȴ��25�棬���ˣ�
���Դ��ǣ�������Ũ��ԼΪ7 molL��1����ȴ��25�棬���ˣ���6��a��������δ��ֳ�ȥ����As2O3�к���CaSO4����ȷ��
b����Һ2Ϊ���ᣬ��ѭ��ʹ�ã������Ļ����ʣ���ȷ��
c��ͨ���ȡ����顱���ữ����˳���Դﵽ������Ԫ�ص�Ŀ�ģ���ȷ��
���Դ��ǣ�abc��
