题目内容
【题目】氮族元素单质及其化合物有着广泛应用。
(1)在1. 0 L密闭容器中放入0. 10mol PCl5(g),一定温度进行如下反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH1,反应时间(t)与容器内气体总压强(p/100kPa)的数据见下表:
PCl3(g)+Cl2(g) ΔH1,反应时间(t)与容器内气体总压强(p/100kPa)的数据见下表:
时间t/s 温度 | 0 | t1 | t2 | t3 | t4 | t5 |
T1 | 5. 00 | 7. 31 | 8. 00 | 8. 50 | 9. 00 | 9. 00 |
T2 | 6. 00 | -- | -- | -- | 11. 00 | 11. 00 |
回答下列问题:
①PCl3的电子式为_______。
②T1温度下,反应平衡常数K=______。
③T1___T2(填“>”、“<”或“=”,下同),PCl5的平衡转化率α1(T1) __α2(T2)。
(2)NO在一定条件下发生如下分解:3NO(g)![]() N2O(g)+NO2(g)
N2O(g)+NO2(g)
在温度和容积不变的条件下,能说明该反应已达到平衡状态的是________(填字母序号)。
a. n(N2O)=n(NO2) b. 容器内压强保持不变 c. v正(N2O)=v逆(NO2) d. 气体颜色保持不变
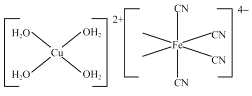
(3)次磷酸钴[Co(H2PO2)2]广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如下图。

①Co的电极反应式为_______。
②A、B、C为离子交换膜,其中B为____离子交换膜(填“阳”或“阴”)。
【答案】![]() 0.32 mol·L-1 < < b、c、d Co-2e-=Co2+ 阴
0.32 mol·L-1 < < b、c、d Co-2e-=Co2+ 阴
【解析】
(1) ① P原子最外层有5个电子,Cl原子最外层有7个电子,P原子与3个Cl原子形成3个共用电子对,PCl3的电子式为![]() ;因此,本题正确答案是:
;因此,本题正确答案是:![]() 。
。
②相同条件下压强之比等于物质的量之比,反应后气体的总物质的量为9×0.1/5=0.18mol,
PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
开始 0.1 0 0
转化 x x x
平衡 0.1-x x x
0.1-x+x+x=0.18,计算得出x=0.08;K=0.08×0.08/0.02=0.32;因此,本题正确答案是:0.32 mol·L-1。
③体积、物质的量不变,则压强与温度成正比,由表中数据可以知道, T1<T2;分解反应为吸热反应,焓变为正,升高温度平衡正向移动,可以知道PCl5的平衡转化率α1(T1) <α2(T2)。,因此,本题正确答案是: <, <。
(2)a. n(N2O)=n(NO2),没有指明正逆反应速率,不能说明该反应已达到平衡状态,错误;
b.该反应为气体体积减小的反应,因此当容器内压强保持不变时,反应达到平衡状态,正确;
c. v正(N2O)=v逆(NO2),标明正逆反应速率,且满足速率之比和系数成正比,可以判定反应已达到平衡状态,正确;
d. 气体颜色保持不变,也就是气体的浓度不发生变化,反应达到平衡状态,正确;
综上所述,本题选b、c、d 。
(3)①Co做为电解池的阳极,Co失电子,发生氧化反应,则Co的电极反应式为Co-2e-=Co2+;综上所述,本题答案是:Co-2e-=Co2+ 。
②产品室可得到次磷酸钴的原因是:阳极室的Co2+通过阳离子交换膜进入产品室,原料室的H2PO2-通过阴离子交换膜进入产品室与Co2+结合生成Co(H2PO2)2,所以B是阴离子交换膜;综上所述,本题答案是:阴。

【题目】(在Na+浓度为0.5 mol/L的某澄清溶液中,还可能含有下表中的若干种离子。(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
阴离子 | NO3- | CO32- | SiO32- | SO42- |
现取该溶液100mL进行如下实验(气体体积在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 生成白色胶状沉淀并放出标准状况下0.56 L气体 |
Ⅱ | 将Ⅰ中产生的混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)实验Ⅰ能确定一定不存在的离子是________;
(2)实验Ⅰ中生成气体的离子方程式为________;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)_____。
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c(mol/L) | 0.25mol/L |
(4)判断K+是否存在,若存在,其最小浓度为________,若不存在,请说明理由:________。
【题目】将一定量的SO2(g)和O2(g)置于一恒容密闭容器中,在不同温度下进行反应(已知该反应为放热反应)。实验记录得到下表中的两组数据:下列有关说法中不正确的是( )
实验序号 | 温度(℃) | 平衡常数(L/mol) | 起始量/mol | 平衡量/mol | 达到平衡所需时间(min) | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. 表中x=1.6;y=0.2B. 表中t>6
C. 表中K1、K2的关系:K2>K1D. 实验1在前6min的反应速率υ(SO2)=0.2mol/(Lmin)
【题目】短周期金属元素甲~戊在周期表中的相对位置如下表所示,下面判断不正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A. 金属性:甲<丙
B. 最高价氧化物对应的水化物的碱性:丙>丁>戊
C. 原子半径:丁>丙>甲
D. 最外层电子数:乙>甲