��Ŀ����
����Ŀ��K4[Fe(CN)6]�������������ᡢҩ��ȡ�
(1)Fe2+�ĺ�������Ų�ʽΪ_____��
(2)CN����Cԭ�ӹ�����ӻ�����Ϊ_____����CN����Ϊ�ȵ������һ�ַ��ӵĽṹʽΪ_____��
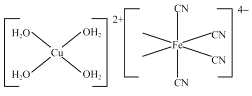
(3)[Cu(H2O)4]2+�ṹʾ��ͼ��ͼ��ʾ��[Fe(CN)6]4���ṹʾ��ͼ��ͼ��ʾ������ͼ����Ӧλ�ò�������_________��
(4)��֪3K4Fe(CN)6![]() 12KCN+Fe3C+3C+(CN)2��+2N2����(CN)2��������������������Ŀ��n(��)��n(��)��_____��
12KCN+Fe3C+3C+(CN)2��+2N2����(CN)2��������������������Ŀ��n(��)��n(��)��_____��
(5)����ý�Ǻϳɰ���Ӧ�Ĵ������������ڵ�ԭ�ӡ���ԭ�����������ϵĵ��㸽�žֲ�ʾ����ͼ��ʾ�����������ϵ�ԭ������ԭ�ӵ���Ŀ��Ϊ_____��

���𰸡�[Ar]3d6��1s22s22p63s23p63d6 sp N��N��C��O 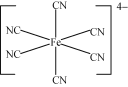 3��4 1��2
3��4 1��2
��������
��1����������ԭ������ع�����д���������Ų�ʽ��
��2������ԭ�ӵ��ӻ������ж����ӻ����ͣ��ٽ�ϵȵ�����ԭ�������ҳ���ȵ����壻
��3��������������ۣ��������ṩ�µ��ӶԵ�ԭ��ΪC�����[Cu(H2O)4]2���ṹʾ��ͼ���ɣ�
��4������C��Nԭ������8�����ȶ��ṹ����ȷ��д��ṹʽ�����ݹ��ۼ������ҵ���������������������Ŀ��
��5���þ�����ÿ��Nԭ����Χ��4��Feԭ�ӡ�ÿ��Feԭ����Χ��2��Nԭ�ӣ����þ�̯������������������Fe��Nԭ�����ı�ֵ��
��1��Fe��ԭ������Ϊ26��Fe2���ĺ��������Ϊ24��Fe2���ĺ�������Ų�ʽΪ[Ar]3d6��1s22s22p63s23p63d6��
�ʴ�Ϊ��[Ar]3d6��1s22s22p63s23p63d6��
��2��CN�����ӻ������Ϊ2��δ�ӻ���2��p����γ�2���������������sp�ӻ���ʽ��N2��CO������CN-��ԭ������Ϊ2���۲��������Ϊ10����Ϊ�ȵ����壬����CN����Ϊ�ȵ������һ�ַ��ӵĽṹʽΪN��N��C��O��
�ʴ�Ϊ��sp��N��N��C��O��
��3��[Fe(CN)6]4������λ��Ϊ6����ͼ�п��Կ����������е�Cԭ���ṩ�¶Ե�������������Fe2+�γ���λ��������ṹʾ��ͼ�ɱ�ʾΪ��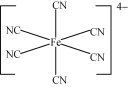 ��
��
�ʴ�Ϊ�� ��
��
��4��(CN)2���ӵĽṹʽΪN��C-C��N������һ�����۵���Ϊһ��������һ����������Ϊһ��������2��������֪����÷����ڷ�����������3����������4������CN)2��������������������Ŀ��n(��)��n(��)��3��4��
�ʴ�Ϊ��3��4��
��5���þ�����ÿ��Nԭ����Χ��4��Feԭ�ӡ�ÿ��Feԭ����Χ��2��Nԭ�ӣ����þ�̯��֪���������ϵ�ԭ������ԭ�ӵ���Ŀ��Ϊ=![]() ��
��![]() = 1��2��
= 1��2��
�ʴ�Ϊ��1��2��

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�����Ŀ������Ԫ�ص��ʼ��仯�������Ź㷺Ӧ�á�
��1����1. 0 L�ܱ������з���0. 10mol PCl5(g)��һ���¶Ƚ������·�Ӧ:PCl5(g)![]() PCl3(g)��Cl2(g) ��H1����Ӧʱ��(t)��������������ѹǿ(p/100kPa)�����ݼ��±���
PCl3(g)��Cl2(g) ��H1����Ӧʱ��(t)��������������ѹǿ(p/100kPa)�����ݼ��±���
ʱ��t/s �¶� | 0 | t1 | t2 | t3 | t4 | t5 |
T1 | 5. 00 | 7. 31 | 8. 00 | 8. 50 | 9. 00 | 9. 00 |
T2 | 6. 00 | -- | -- | -- | 11. 00 | 11. 00 |
�ش���������:
��PCl3�ĵ���ʽΪ_______��
��T1�¶��£���Ӧƽ�ⳣ��K=______��
��T1___T2�����������������������ͬ����PCl5��ƽ��ת���ʦ�1(T1) __��2(T2)��
��2��NO��һ�������·������·ֽ⣺3NO(g)![]() N2O(g)+NO2(g)
N2O(g)+NO2(g)
���¶Ⱥ��ݻ�����������£���˵���÷�Ӧ�Ѵﵽƽ��״̬����________(����ĸ���)��
a. n(N2O)=n(NO2) b. ������ѹǿ���ֲ��� c. v��(N2O)=v��(NO2) d. ������ɫ���ֲ���
��3����������[Co(H2PO2)2]�㷺���ڻ�ѧ���ܣ��Խ����ܺʹ�������Ϊԭ�ϣ��������ҵ������۵�ⷨ�Ʊ���ԭ������ͼ��

��Co�ĵ缫��ӦʽΪ_______��
��A��B��CΪ���ӽ���Ĥ������BΪ____���ӽ���Ĥ�����������������


