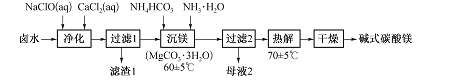
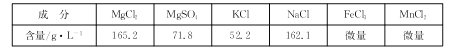
题目内容
【题目】氮氧化物是目前造成大气污染的主要气体。NO在空气中存在如下反应:
![]()
(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变
△H2用含△H、△H1的式子来表示):
①![]()
②________。
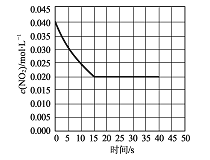
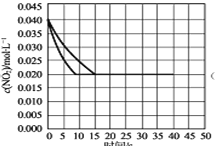
(2)在某温度下的一密闭容器中充人一定量的N02发生上述反应,测得NO2的浓度随时间的变化曲线如下图所示,前5秒内O2的平均生成速率为 mol.L-1.s-l,该条件下反应:2NO+O2![]() 2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g)
2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g)![]() 2NO2 (g)△H (填“>”或“<”)0。
2NO2 (g)△H (填“>”或“<”)0。
(3)2NO(g)+O2(g)![]() 2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g)
2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g)![]() 2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g)
2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g)![]() 2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
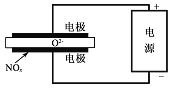
(5)电解法处理氮氧化物是目前大气污染治理的一个新思路。其原理是将NO.在电解池中分解成无污染的N2和02除去,如图所示,,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-。则电解池阴极的电极反应式为_____________
【答案】(1)N2O2(g)+O2(g)=2NO2(g)△H2=△H-△H1;(2)0.001;100;<;(3)决定总反应速率的是反应②,温度升高后反应①向左移动,造成N2O2的浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,导致反应②的速率变慢;
(4) ;
;
(5)2NOx+4xe-=N2+2xO2-。
【解析】
试题分析:(1)总式减去①,得出N2O2(g)+O2(g)=2NO2(g)△H2=△H-△H1;(2)根据化学反应速率的定义,v(NO2)=(0.04-0.03)/5mol/(L·s)=0.002mol/(L·s),根据反应速率之比等于化学计量数之比,即v(O2)=v(NO2)/2=0.001mol/(L·s),2NO2(g)![]() 2NO(g)+O2(g),K=c2(NO)×c(O2)/c2(NO2)=0.022×0.01/0.022=0.01,2NO(g)+O2(g)
2NO(g)+O2(g),K=c2(NO)×c(O2)/c2(NO2)=0.022×0.01/0.022=0.01,2NO(g)+O2(g)![]() 2NO2(g),此时的平衡常数=1·K-1=100;升高温度,平均摩尔质量减少,说明平衡向逆反应方向进行,根据勒夏特列原理,正反应方向为放热反应,即△H<0;(3)根据信息,反应②是一个慢反应,决定反应速率是慢反应,即反应②温度升高后反应①向左移动,造成N2O2的浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,导致反应②的速率变慢;(4)使用催化剂,加快反应速率,对化学平衡无影响,因此图像是:
2NO2(g),此时的平衡常数=1·K-1=100;升高温度,平均摩尔质量减少,说明平衡向逆反应方向进行,根据勒夏特列原理,正反应方向为放热反应,即△H<0;(3)根据信息,反应②是一个慢反应,决定反应速率是慢反应,即反应②温度升高后反应①向左移动,造成N2O2的浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,导致反应②的速率变慢;(4)使用催化剂,加快反应速率,对化学平衡无影响,因此图像是:

(5)阴极上得到电子化合价降低,根据装置图,NOx在阴极上得电子,根据电解原理,阴离子向阳极移动,即阴极上产生O2-,因此阴极电极反应式为2NOx+4xe-=N2+2xO2-。