题目内容
【题目】五种短周期元素Q、W、X、Y、Z,位于不同主族,原子序数依次增大。
①W的氢化物与最高价氧化物对应水化物反应生成盐甲
②X、Y、Z的最高价氧化物对应水化物之间两两反应生成均可生成盐和水
③化合物X2O2可与Q的某种气态氧化物(标准状况下密度为1.25gL-1)在一定条件下发生化合反应,生成一种正盐乙
请回答下列各题:
(1)已知:ZO3n-+M2++H+→Z―+M4++H2O(M为金属元素,方程式未配平),则Z原子的结构示意图为___,n=___
(2)过程③的化学方程式为___。
(3)甲的水溶液呈___性(填“酸”、“碱”或“中”),原因是___(用离子方程式表示)。
(4)将Y单质粉末加入到盐乙的浓溶液中,缓慢放出气泡,加热后有大量气泡生成,同时生成白色沉淀丙。经检验气体是由单质A和少量Q的最高价氧化物组成。下列有关说法正确的是___。
A.Q元素是形成化合物种类最多的元素
B.单质A是热值最高的物质
C.白色沉淀丙既可溶于稀盐酸,也能溶于NaOH
D.白色沉淀丙可能是由生成的YO2-离子与溶液中存在的某种离子反应生成
(5)Y可形成三元半导体CuYO2,此三元半导体难溶于水,可溶于稀硝酸,且有NO生成,写出溶解过程的离子方程式___。
【答案】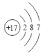 1 Na2O2+CO
1 Na2O2+CO![]() Na2CO3 酸 NH4++H2O
Na2CO3 酸 NH4++H2O![]() NH3H2O+H+ ABCD 3CuAlO2+16H++NO3-=3Cu2++3Al3++NO↑+8H2O
NH3H2O+H+ ABCD 3CuAlO2+16H++NO3-=3Cu2++3Al3++NO↑+8H2O
【解析】
W元素的气态氢化物与W元素的最高价氧化物对应的水化物能反应生成盐,可知W是N元素(NH3+HNO3=NH4NO3),所以甲为硝酸铵;X、Y、Z的最高价氧化物对应水化物之间两两反应生成均可生成盐和水,可知X的最高价氧化物对应水化物为强碱,Z的最高价氧化物强酸,所以X为Na,Y为Al,W为S或Cl;因为Q气态氧化物(标准状况下密度为1.25gL-1)推知摩尔质量为28g/mol,且能与Na2O2反应,所以Q为C,盐乙为碳酸钠,据此回答本题。
(1)、因为Z―带一个单位负电,所以Z为Cl,故答案为: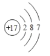 ,1;
,1;
(2)、Na2O2+CO![]() Na2CO3;
Na2CO3;
(3)、因为甲溶液为硝酸铵溶液,铵根离子水解显酸性,故答案为:酸,NH4++H2O![]() NH3H2O+H+;
NH3H2O+H+;
(4)、碳酸钠溶液因为碳酸根离子水解显碱性,所以Al与氢氧根反应产生氢气,加热同时促进碳酸根离子水解产生二氧化碳,与偏铝酸根反应产生氢氧化铝沉淀,所以沉淀丙为氢氧化铝,A为氢气,故ABCD均正确;
(5)、CuAlO2与硝酸的离子反应方程式为:3CuAlO2+16H++NO3-=3Cu2++3Al3++NO↑+8H2O