题目内容
下列说法错误的是( )
| A、由单质A转化为单质B,△H=+119kJ/mol,可知单质A比单质B稳定 | B、灼热的碳与CO2反应既是氧化还原反应,又是生成物总能量高于反应物总能量的反应 | C、决定化学反应速率的根本因素是参加反应的各物质的结构和性质 | D、对于一个可逆反应(△H<0)达到平衡后,升高温度可以增加活化分子的百分数,提高有效碰撞的次数,使V正增大的倍数大于V逆增大的倍数,从而使化学反应平衡逆向移动 |
分析:A、能量越低越稳定;
B、碳与CO2反应中存在化合价的变化,而且是吸热反应;
C、不同物质反应速率不同,决定化学反应速率的根本因素是参加反应的各物质的结构和性质;
D、化学反应平衡逆向移动,则V正增大的倍数小于V逆增大的倍数.
B、碳与CO2反应中存在化合价的变化,而且是吸热反应;
C、不同物质反应速率不同,决定化学反应速率的根本因素是参加反应的各物质的结构和性质;
D、化学反应平衡逆向移动,则V正增大的倍数小于V逆增大的倍数.
解答:解:A、能量越低越稳定,由单质A转化为单质B,△H=+119kJ/mol,则B的能量高,所以单质A比单质B稳定,故A正确;
B、碳与CO2反应中存在化合价的变化属于氧化还原反应,而且是吸热反应,所以生成物总能量高于反应物总能量,故B正确;
C、不同物质反应速率不同,决定化学反应速率的根本因素是参加反应的各物质的结构和性质,故C正确;
D、对于一个可逆反应(△H<0)达到平衡后,升高温度可以增加活化分子的百分数,提高有效碰撞的次数,使V正增大的倍数小于V逆增大的倍数,即V逆>V正,从而使化学反应平衡逆向移动,故D错误;
故选D.
B、碳与CO2反应中存在化合价的变化属于氧化还原反应,而且是吸热反应,所以生成物总能量高于反应物总能量,故B正确;
C、不同物质反应速率不同,决定化学反应速率的根本因素是参加反应的各物质的结构和性质,故C正确;
D、对于一个可逆反应(△H<0)达到平衡后,升高温度可以增加活化分子的百分数,提高有效碰撞的次数,使V正增大的倍数小于V逆增大的倍数,即V逆>V正,从而使化学反应平衡逆向移动,故D错误;
故选D.
点评:本题考查了物质稳定性与能量的关系、氧化还原反应的判断、影响反应速度的因素等,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
下列说法错误的是( )
| A、C2H4和C4H8一定都能使溴水退色 | B、C2H6和C4H10一定是同系物 | C、C3H6不只表示一种物质 | D、烯烃中各同系物中碳的质量分数相同 |
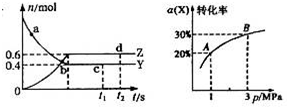 (2013?枣庄二模)一定温度下的密闭容器中发生反应:X(g)+3Y(g)f?2Z(g)△H<0,如图是反应达平衡及改变条件平衡移动的图象.下列说法错误的是( )
(2013?枣庄二模)一定温度下的密闭容器中发生反应:X(g)+3Y(g)f?2Z(g)△H<0,如图是反应达平衡及改变条件平衡移动的图象.下列说法错误的是( )