题目内容
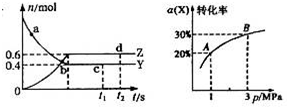 (2013?枣庄二模)一定温度下的密闭容器中发生反应:X(g)+3Y(g)f?2Z(g)△H<0,如图是反应达平衡及改变条件平衡移动的图象.下列说法错误的是( )
(2013?枣庄二模)一定温度下的密闭容器中发生反应:X(g)+3Y(g)f?2Z(g)△H<0,如图是反应达平衡及改变条件平衡移动的图象.下列说法错误的是( )分析:A.可逆反应达到平衡状态时,正逆反应速率相等;
B.根据参加反应的Z的量计算参加反应的Y的物质的量,再加上平衡的物质的量就是其起始物质的量;
C.平衡常数只与温度有关;
D.增大压强平衡向气体体积减小的方向移动,根据反应热进行计算.
B.根据参加反应的Z的量计算参加反应的Y的物质的量,再加上平衡的物质的量就是其起始物质的量;
C.平衡常数只与温度有关;
D.增大压强平衡向气体体积减小的方向移动,根据反应热进行计算.
解答:解:A.c点和d点都是同一温度下的平衡状态,所以X的正逆反应速率相等,故A正确;
B.该反应中参加反应的Z的物质的量=0.6mol,根据方程式知,参加反应的Y的物质的量=
×0.6mol=0.9mol,平衡时Y的物质的量是0.4mol,所以反应初始Y的物质的量是1.3mol,故B正确;
C.温度不变平衡常数不变,所以K(A)=K(B),故C错误;
D.平衡状态由A变到B时,P(A)<P(B),增大压强平衡向正反应方向移动,正反应是放热反应,所以放出的热量:Q(A)<Q(B),故D正确;
故选C.
B.该反应中参加反应的Z的物质的量=0.6mol,根据方程式知,参加反应的Y的物质的量=
| 3 |
| 2 |
C.温度不变平衡常数不变,所以K(A)=K(B),故C错误;
D.平衡状态由A变到B时,P(A)<P(B),增大压强平衡向正反应方向移动,正反应是放热反应,所以放出的热量:Q(A)<Q(B),故D正确;
故选C.
点评:本题考查图象分析题,明确曲线变化趋势及拐点的含义是解本题关键,注意温度、压强对化学平衡的影响,难度不大.

练习册系列答案
相关题目