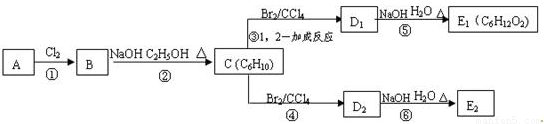
题目内容
(15分) Ⅰ、某同学用下图所示装置(尾气吸收装置未画出)向溶液Y中通入NH3和CO2
(1)下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH e.浓氨水
f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 (用药品序号填
空,下同);装置D处固体药品的最佳选择为 (用药品序号填空)。
(2)下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
A.MnO2与浓盐酸反应制备Cl2 B.Cu与浓硫酸反应生成SO2
C.由H2O2分解制O2 D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
(3)写出上述装置A处的试管中所发生反应的化学方程式:
。
Ⅱ、甲同学利用下图所示装置探究SO2和Cl2两种气体按不同比例混合后的漂白性。
试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:
。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: (结合反应方程式)。
Ⅰ、(1)a、c ; b (2)C E (3)2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
Ⅱ、①使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比例混合。②SO2和Cl2按1∶1进气,二者恰好完全反应,生成无漂白性的H2SO4和HCl。 SO2+Cl2+2H2O==4H++SO42-+2Cl-
解析:略

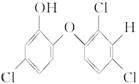 ,下列有关说法不正确的是( )
,下列有关说法不正确的是( )
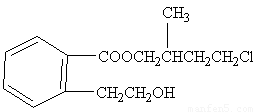
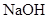 水溶液中加热得到B和C,C是芳香族化合物,则C的结构简式是 。
水溶液中加热得到B和C,C是芳香族化合物,则C的结构简式是 。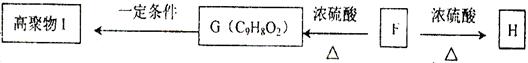
 溶液发生显色反应
溶液发生显色反应