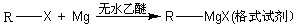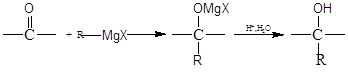题目内容
(15分)已知某有机物A的质谱图显示其相对分子质量为84,则
(1) 烃A的分子式为_____________。
(2) 若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
(3) 若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为 。
(4) 比烃A少一个碳原子且能使溴水褪色的A的同系物有________种同分异构体。
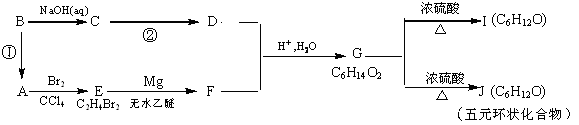
(5)若烃A红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
反应②的化学方程式为: ______________________;
C的化学名称为_______________________;
E2的结构简式是________________;
⑥的反应类型是______________________ 。
(15分)⑴ C6H12; (2分) (2) 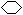 ; (2分)
; (2分)
(3) (CH3)3CCH=CH2或CH2=C(CH3)CH(CH3)2或 (CH3)2C=C(CH3)2; (3分)
(4) 5 (2分)
(5)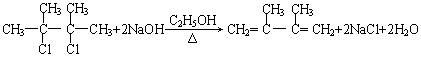 (2分)
(2分)
2,3-二甲基-1,3-丁二烯(1分)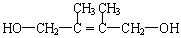 (2分) 取代反应(各1分)
(2分) 取代反应(各1分)
解析

尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l) △H2
H2O+ H2NCONH2(l) △H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。

已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定, 总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变, 固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
|
温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g) △H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) △H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ • mol-1。
(4)尿素燃料电池的结构如图所示。其工作时 负极电极反应式可表示为______。

尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l) △H2
H2O+ H2NCONH2(l) △H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。

①已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定,总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变, 固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
|
温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g) △H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) △H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ • mol-1。
(4)尿素燃料电池的结构如图所示。其工作时 负极电极反应式可表示为______。