题目内容
【题目】电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。如图是向20mL0.01mol/LBa(OH)2溶液中滴入了2滴酚酞溶液,然后向Ba(OH)2溶液中匀速滴加0.2mol/LH2SO4溶液,获得电导率随时间变化的曲线图。
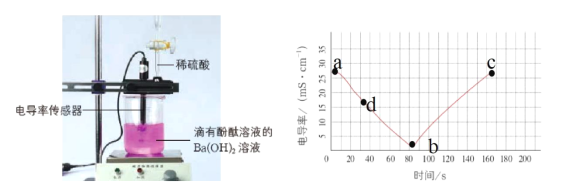
(1)0-80s观察到的实验现象是_____。
(2)写出该实验中的离子方程式_____。
(3)截至b点,加入0.2molL-1H2SO4溶液的体积为_____mL,解释b点的电导率不等于零和bc段电导率又增加的原因____。
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是(_____)(多选题)
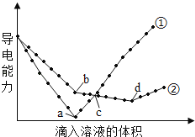
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同量的OH-
E.H+导电能力比Na+强
【答案】产生白色沉淀,溶液红色褪去,电导率减小 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O 1 b点:BaSO4在水中溶解度很小,溶液中SO42-和Ba2+浓度很小但不等于0。水存在微弱的电离,溶液中H+和OH-浓度很小但不等于0。溶液中有自由移动的离子,电导率不等于零。bc段:b点溶液中的Ba(OH)2被反应完,溶液中自由移动的离子浓度达到最小值,随着H2SO4溶液的不断滴加,溶液中H+和SO42-浓度变大,自由移动离子浓度变大,bc段电导率增加。 ABCE
【解析】
溶液的导电性由溶液中离子的浓度及离子电荷数决定,Ba(OH)2 是强电解质,开始滴定时溶液中离子浓度较大,溶液的电导率大,随反应的进行,溶液中钡离子生成硫酸钡沉淀,氢氧根离子变成水,恰好完全反应时,溶液中主要是水和极少量的硫酸钡,水是弱电解质,再继续加入硫酸,硫酸是强电解质,离子浓度增大,导电能力增强。
(1)0—80s,Ba(OH)2 是强电解质,开始滴定时溶液中离子浓度较大,溶液的电导率大,随反应的进行,溶液中钡离子生成硫酸钡沉淀,氢氧根离子变成水,恰好完全反应时,溶液中主要是水和极少量的硫酸钡。观察到的实验现象是产生白色沉淀,溶液红色褪去,电导率减小。
(2)该实验中硫酸与氢氧化钡反应生成硫酸钡沉淀和水,离子方程式2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O。
(3)截至b点,加入0.2molL-1H2SO4溶液的体积为V=20mL×0.01mol/L÷0.2molL-1=1mL;b点的电导率不等于零和bc段电导率又增加的原因: b点:BaSO4在水中溶解度很小,溶液中SO42-和Ba2+浓度很小但不等于0。水存在微弱的电离,溶液中H+和OH-浓度很小但不等于0。溶液中有自由移动的离子,电导率不等于零。bc段:b点溶液中的Ba(OH)2被反应完,溶液中自由移动的离子浓度达到最小值,随着H2SO4溶液的不断滴加,溶液中H+和SO42-浓度变大,自由移动离子浓度变大,bc段电导率增加。
(4)A.溶液中钡离子与SO42-生成硫酸钡沉淀,氢氧根离子与H+生成水,曲线①中a点溶液的导电能力接近0,①代表滴加H2SO4溶液的变化曲线,故A正确;
B.②是NaHSO4溶液与氢氧化钡反应,b点,氢氧化钡与硫酸氢钠以1:1物质的量之比反应生成硫酸钡、水和NaOH,溶液中有NaOH,溶液中大量存在的离子是Na+、OH-,故b正确;
C.a、d两点均将氢氧化钡全部反应,a点硫酸与氢氧化钡恰好反应生成硫酸钡和水,d点硫酸氢钠与氢氧化钡恰好反应生成硫酸钡、硫酸钠和水,a和d之后,硫酸均过量,a和d对应的溶液均显中性,故C正确;
D.c点,两溶液中导电能力相同,对曲线①硫酸过量,溶液呈酸性,对曲线②OH-未被完全中和,溶液呈碱性,OH-含量不相同,故D错误;
E.根据曲线①和②导电能力的变化幅度分析,H+导电能力比Na+强,故E正确;
故选ABCE。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案