题目内容
【题目】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解等,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1,则该温度下水的离子积常数KW=_______mol2L-2;该温度下,pH=2的H2SO4溶液中由水电离出的[H+]为_________ molL-1。
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl ②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度由大到小顺序为__________________(用序号回答)。
(3)25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=______ molL-1,a____ b(填“﹥”、“﹤”或“=”)。
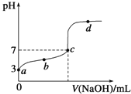
(4)常温下,稀释0.5 mol·L1的醋酸溶液,下图中的纵坐标不能表示_________

A.CH3COOH的电离程度 B.溶液中H+的数目
C.溶液中![]() 的值 D.溶液中CH3COOH的浓度
的值 D.溶液中CH3COOH的浓度
【答案】1×10-12 1×10-10 ④①②③ 0.5a > D
【解析】
(1)水的离子积常数Kw=c(H+)c(OH-)=1×10-6×1×10-6=1×10-12 mol2·L-2;该温度下,pH=2的H2SO4溶液中氢离子浓度为0.01mol/L,则由水电离出的c(H+)为= ![]() mol/L =1×10-10mol·L-1;
mol/L =1×10-10mol·L-1;
(2)酸和碱都会抑制水的电离,相同物质的量浓度的氢氧化钠和硫酸因为硫酸电离出的氢离子浓度为氢氧化钠中的氢氧根离子浓度的2倍,所以前者水电离程度更大,铵根离子水解促进水的电离,所以水的电离程度由大到小的顺序为:④①②③;
(3) 25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中物料守恒分析,c(CH3COO-)+c(CH3COOH)=0.5a mol·L-1;若二者恰好完全反应则溶液为碱性,所以为了使混合后溶液为中性,则需要酸过量,即a>b;
(4) A.醋酸溶液中加入水,随着水的量增加,CH3COOH的电离程度增大,故正确;B.醋酸电离程度增大,溶液中H+的数目增加,故正确;C.电离程度增大,所以溶液中![]() 的值增大,故正确;D.电离程度增大,溶液中CH3COOH的浓度减小,故错误。故选D。
的值增大,故正确;D.电离程度增大,溶液中CH3COOH的浓度减小,故错误。故选D。

 名校课堂系列答案
名校课堂系列答案【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
【题目】氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应N2+3H2![]() 2NH3。该可逆反应达到平衡的标志是________。
2NH3。该可逆反应达到平衡的标志是________。
A.3v正(H2)=2v逆(NH3)
B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中,测得如下表所示数据。
时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
10 | 0.21 | 0.81 | 0.19 | 0.64 |
请回答下列问题:
①该温度下,上述反应的平衡常数K=________;
②反应在7~10 min内,CO的物质的量减少的原因可能是________(填字母)。
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
③若保持相同的温度,向2 L的恒容密闭容器中同时充入0.2 mol CH4、0.6 mol H2O、a mol CO和0.5 mol H2,当a=0.2时,上述反应向________(填“正反应”或“逆反应”)方向进行。若要使上述反应开始时向逆反应方向进行,则a的取值范围为________(已知:0.253=0.0156)
【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
A.在某溶液中加入盐酸后无现象,再加BaCl2产生白色沉淀证明有SO42- | B.样品中加NaOH溶液加热,蓝色石蕊试纸变红,证明检验样品中有NH4+的存在 | C.将混有少量氯化钾的硝酸钾饱和溶液在冰水中冷却,KNO3晶体先析出 | D.将灼热的铜丝伸入盛有氯气的集气瓶中,铜丝剧烈燃烧,产生棕黄色的烟 |
A.AB.BC.CD.D