题目内容
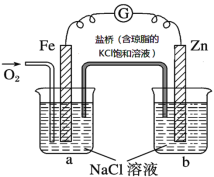
【题目】美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O,电池示意如图,

下列说法不正确的是()
A.a极为电池的负极
B.电池工作时,1mol乙醇被氧化时就有6mol电子转移
C.电池正极的电极反应为:4H+ + O2 + 4e-=2H2O
D.电池工作时电流由b极沿导线经灯泡再到a极
【答案】B
【解析】
由质子的定向移动方向可知a为负极,b为正极,负极发生氧化反应,乙醇被氧化生成CO2和氢离子,电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,正极上氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,结合原电池原理分析解答。
A.原电池工作时,阳离子向正极移动,由质子的定向移动方向可知a为负极,故A正确;
B.由电极反应式C2H5OH+3H2O-12e-=2CO2+12H+,1mol乙醇被氧化失去12mol电子,故B错误;
C.正极上氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,故C正确;
D.电池工作时,电流由正极经外电路流向负极,在该电池中由b极沿导线经灯泡流向a极,故D正确;
故选B。

【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
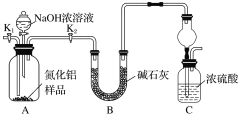
现利用如图装置制备SOCl2。

请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为___(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式);请设计实验验证装置C中生成的盐中含有SO42-:____。