题目内容
5.下列各含氧酸中酸性最强的是( )| A. | HClO2 | B. | H2SO4 | C. | H2SO3 | D. | HClO4 |
分析 含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强,将选项中含氧酸改写成XOm(OH)n形式,根据非羟基氧原子数目判断.
解答 解:A、HClO2可以为ClO(OH),非羟基氧原子数目为1,
B、H2SO4可以改写为SO2(OH)2,非羟基氧原子数目为2;
C、H2SO3可以改写为SO(OH)2,非羟基氧原子数目为1;
D、HClO4可以改写为ClO3(OH)1,非羟基氧原子数目为3;
HClO4中非羟基氧原子数目最多,酸性最强,
故选D.
点评 本题考查了酸性强弱比较,根据含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,非羟基氧原子数目越大,酸性越强进行判断,本题难度中等.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
16.下列说法正确的是( )
| A. | 在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫该物质的燃烧热 | |
| B. | 弱酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热 | |
| C. | 燃烧热或中和热是反应热的两种 | |
| D. | 101 kPa时,纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫该物质的燃烧热 |
20.短周期元素A、B、C的原子序数依次递增,三者原子最外层电子数之和为14,A原子的次外层电子数等于B原子的最外层电子数,A与C同主族.则下列叙述正确的是( )
| A. | 原子半径:A<B<C | |
| B. | B与A的化合物比A与C 的化合物熔点低 | |
| C. | 氢化物稳定性:A<C | |
| D. | A与C的化合物属于大气污染物 |
10.下列各组混合物不论它们的组分以何种比例混合,只要总质量一定,经过完全燃烧后,产生的CO2为一定量的是( )
| A. | 乙烷和乙烯 | B. | 丙烯和丙烷 | ||
| C. | 甲烷和己烷 | D. | 乙炔和乙烯基乙炔( CH2=CH-C≡CH) |
14.下列叙述中不正确的是( )
| A. | 两原子,如果核外电子数相同,则一定属于同种元素 | |
| B. | 两种微粒,若核外电子数相同,则其化学性质一定相同 | |
| C. | 在多电子的原子里不同电子层的核外电子的能量是不相同的 | |
| D. | 能量低的电子在离核近的区域运动 |
15.在硫酸铝、硫酸钾和明矾的混合溶液中,如果SO42-的浓度为0.2mol•L-1,当加等体积的0.2mol•L-1的KOH溶液时,生成沉淀恰好溶解,则原混合物中K+的浓度是( )
| A. | 0.2mol•L-1 | B. | 0.25mol•L-1 | C. | 0.45mol•L-1 | D. | 0.225mol•L-1 |
 材料是人类赖以生存和发展的重要物质基础.回答下一问题:
材料是人类赖以生存和发展的重要物质基础.回答下一问题: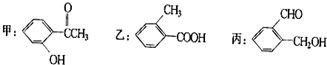 今有化合物:
今有化合物: