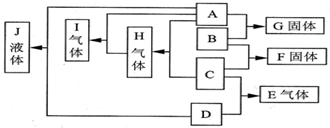
题目内容
 已知A、B、C、D均为气体,E、F均为常温下呈固体的离子化合物,G为氯化钙,A在B中燃烧的火焰呈苍白色,反应②中两气体相遇有大量白烟,它们之间的转化关系如图所示:
已知A、B、C、D均为气体,E、F均为常温下呈固体的离子化合物,G为氯化钙,A在B中燃烧的火焰呈苍白色,反应②中两气体相遇有大量白烟,它们之间的转化关系如图所示:(1)写出A、C的化学式:A:
H2
H2
,C:HCl
HCl
.(2)D的电子式为


三角锥
三角锥
形.(3)在反应①~③中,属于氧化还原反应的是
①
①
.(4)反应②的化学方程式为:
NH3+HCl=NH4Cl
NH3+HCl=NH4Cl
;反应③的化学方程式为:2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑
2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑
.分析:A在B中燃烧的火焰呈苍白色,A为H2,B为Cl2,C为HCl,反应②中两气体相遇有大量白烟,则D为NH3,所以E为NH4Cl,E、F均为常温下呈固体的离子化合物,则F为Ca(OH)2,G为氯化钙,则H为水,然后结合元素化合物性质及化学用语来解答.
解答:解:A在B中燃烧的火焰呈苍白色,A为H2,B为Cl2,C为HCl,反应②中两气体相遇有大量白烟,则D为NH3,所以E为NH4Cl,E、F均为常温下呈固体的离子化合物,则F为Ca(OH)2,G为氯化钙,则H为水,
(1)由上述分析可知,A为H2,C为HCl,故答案为:H2;HCl;
(2)D为NH3,其电子式为 ,空间构型为三角锥,故答案为:
,空间构型为三角锥,故答案为: ;三角锥;
;三角锥;
(3)反应①为Cl2+H2
2HCl,反应②为HCl+NH3═NH4Cl,反应③为Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,只有反应①中有元素化合价变化,属于氧化还原反应,
故答案为:①;
(4)反应②为HCl+NH3═NH4Cl,反应③为Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,
故答案为:NH3+HCl=NH4Cl;2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑.
(1)由上述分析可知,A为H2,C为HCl,故答案为:H2;HCl;
(2)D为NH3,其电子式为
 ,空间构型为三角锥,故答案为:
,空间构型为三角锥,故答案为: ;三角锥;
;三角锥;(3)反应①为Cl2+H2
| ||
| ||
故答案为:①;
(4)反应②为HCl+NH3═NH4Cl,反应③为Ca(OH)2+2NH4Cl
| ||
故答案为:NH3+HCl=NH4Cl;2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑.
点评:本题考查无机物的推断,注意利用信息推断各物质是解答的关键,明确氯气的性质及氨气的制法即可解答,实验现象为解答的突破口,题目难度中等.

练习册系列答案
相关题目