题目内容
已知A、B、C、D均为短周期元素,它们的原子序数依次递增. A是最外层为一个电子的非金属元素,C 原子的最外层电子数是次外层的3倍; C和D可形成两种固态化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物.A、B、C三种元素可以形成离子晶体,该晶体中各元素原子的物质的量之比为A:B:C=4:2:3.
请回答下列问题:
(1)写出B的原子结构示意图
 ,写出C和D形成的淡黄色固体化合物的电子式
,写出C和D形成的淡黄色固体化合物的电子式
 .
.
(2)元素原子的物质的量之比为A:B:C=4:2:3 的晶体名称为
(3)请写出与A2C和BA3分子中电子数相同,且仍由A、B、C元素中任意两种元素组成的微粒的符号(举两例)
(4)写出由B、C元素组成且元素原子质量比为B:C=7:12的化合物的化学式
请回答下列问题:
(1)写出B的原子结构示意图




(2)元素原子的物质的量之比为A:B:C=4:2:3 的晶体名称为
硝酸铵
硝酸铵
.(3)请写出与A2C和BA3分子中电子数相同,且仍由A、B、C元素中任意两种元素组成的微粒的符号(举两例)
OH-
OH-
、NH4+
NH4+
.(4)写出由B、C元素组成且元素原子质量比为B:C=7:12的化合物的化学式
N2O3
N2O3
.分析:A是最外层为一个电子的非金属元素,应为H元素,C原子的最外层电子数是次外层的3倍,应为O元素,C和D可形成两种固态化合物,其中一种为淡黄色固体,应为Na2O2,则D为Na元素,B和C可形成多种气态化合物,则B应为N元素,结合元素对应的单质、化合物的性质解答该题.
解答:解:A是最外层为一个电子的非金属元素,应为H元素,C原子的最外层电子数是次外层的3倍,应为O元素,C和D可形成两种固态化合物,其中一种为淡黄色固体,应为Na2O2,则D为Na元素,B和C可形成多种气态化合物,则B应为N元素,则
(1)B应为N元素,原子核外有2个电子层,最外层电子数为5,则原子结构示意图为 ,C和D形成的淡黄色固体化合物为Na2O2,为离子化合物,电子式为
,C和D形成的淡黄色固体化合物为Na2O2,为离子化合物,电子式为 ,故答案为:
,故答案为: ;
; ;
;
(2)元素原子的物质的量之比为A:B:C=4:2:3的化合物为NH4NO3,名称为硝酸铵,故答案为:硝酸铵;
(3)A2C和BA3分子分别为H2O、NH3,都含有10个电子,由A、B、C元素中任意两种元素组成的微粒有OH-、NH4+、H3O+等,故答案为:OH-、NH4+;
(4)B为N元素,C为O元素,已知:m(N):m(O)=7:12,则n(N):n(O)=
:
=2:3,则化学式为N2O3,故答案为:N2O3.
(1)B应为N元素,原子核外有2个电子层,最外层电子数为5,则原子结构示意图为
 ,C和D形成的淡黄色固体化合物为Na2O2,为离子化合物,电子式为
,C和D形成的淡黄色固体化合物为Na2O2,为离子化合物,电子式为 ,故答案为:
,故答案为: ;
; ;
;(2)元素原子的物质的量之比为A:B:C=4:2:3的化合物为NH4NO3,名称为硝酸铵,故答案为:硝酸铵;
(3)A2C和BA3分子分别为H2O、NH3,都含有10个电子,由A、B、C元素中任意两种元素组成的微粒有OH-、NH4+、H3O+等,故答案为:OH-、NH4+;
(4)B为N元素,C为O元素,已知:m(N):m(O)=7:12,则n(N):n(O)=
| 7 |
| 14 |
| 12 |
| 16 |
点评:本题考查元素的推断以及元素化合物的性质,题目难度中等,注意正确推断元素的种类为解答该题的关键,易错点为(4),注意原子个数的计算.

练习册系列答案
相关题目




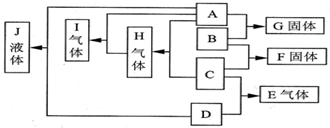

 已知A、B、C、D均为气体,E、F均为常温下呈固体的离子化合物,G为氯化钙,A在B中燃烧的火焰呈苍白色,反应②中两气体相遇有大量白烟,它们之间的转化关系如图所示:
已知A、B、C、D均为气体,E、F均为常温下呈固体的离子化合物,G为氯化钙,A在B中燃烧的火焰呈苍白色,反应②中两气体相遇有大量白烟,它们之间的转化关系如图所示:
