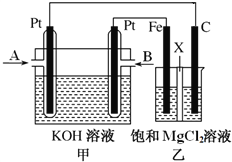
题目内容
【题目】28g铜、银合金与一定量某浓度的硝酸溶液反应,金属完全溶解,放出的气体与2.24L(标准状况下)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是( )
A.3.2g
B.6.4g
C.12.8g
D.21.6g
【答案】B
【解析】解:铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,
n(O2)= ![]() =0.1mol,
=0.1mol,
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=28g
根据电子守恒列方程:2x+1×y=0.1mol×4
解得:x=0.1mol;y=0.2mol
m(Cu)=0.1mol×64g/mol=6.4g,
故选B.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目