题目内容
恒温条件下,将2.0molSO2与amolO2混合通入一密闭容器中,发生如下反应:
2SO2(g)+O2(g)?2SO3(g).反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol.
求:
(1)a的值.
(2)平衡时SO2的转化率.
2SO2(g)+O2(g)?2SO3(g).反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol.
求:
(1)a的值.
(2)平衡时SO2的转化率.
(1)2SO2(g)+O2(g) 2SO3(g).
2SO3(g).
开始(mol):2.0 a 0
变化(mol):1.3 0.65 1.3
平衡(mol):0.7 3.0 1.3
则有 a-0.65=3.0,所以a=3.65;
答:a为3.65;
(2)平衡时SO2的转化率为
×100%=65%;
答:平衡时SO2的转化率为65%.
 2SO3(g).
2SO3(g).开始(mol):2.0 a 0
变化(mol):1.3 0.65 1.3
平衡(mol):0.7 3.0 1.3
则有 a-0.65=3.0,所以a=3.65;
答:a为3.65;
(2)平衡时SO2的转化率为
| 1.3 |
| 2.0 |
答:平衡时SO2的转化率为65%.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
 2H2+O2 2CO+O2
2H2+O2 2CO+O2 4NO(g)+ 6H2O ( g ) ,下列叙述正确的是
4NO(g)+ 6H2O ( g ) ,下列叙述正确的是
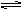 2SO3正反应速率分别用υ(SO2)、υ(O2)、υ(SO3)[mol/(L·min)]表示,逆反应速率分别用υ'(SO2)、υ'(O2)、υ'(SO3)、[mol/(L·min)]表示。当反应达到化学平衡时,正确的关系是( )
2SO3正反应速率分别用υ(SO2)、υ(O2)、υ(SO3)[mol/(L·min)]表示,逆反应速率分别用υ'(SO2)、υ'(O2)、υ'(SO3)、[mol/(L·min)]表示。当反应达到化学平衡时,正确的关系是( )