题目内容
(13分)平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
已知:
ⅰ.酸性条件下,铈在水溶液中有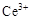 、
、 两种主要存在形式,
两种主要存在形式, 易水解,
易水解, 有较强氧化性。
有较强氧化性。
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于水的净化处理。
(1).操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(2).反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号)。
(3).写出反应①的化学方程式 。
(4).用滴定法测定制得的Ce(OH)4产品纯度。
滴定时所用定量仪器的读数精确为 ;若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5).称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
(1)冷却结晶,取少量溶液于试管中,加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸,若试纸变蓝,则证明含有NH4+;(2)Fe3+、Fe2+;(3)2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O
(4)0.01mol,偏大;(5)Fe2(SO4)3·2(NH4)2SO4·2H2O
解析试题分析:(1)根据示意图可知操作Ⅰ是冷却结晶,然后过滤、洗涤、干燥得到硫酸铁铵。检验硫酸铁铵溶液中含有NH4+的方法是取少量溶液于试管中,加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸,若试纸变蓝,则证明含有NH4+;或取少量溶液于试管中,加入NaOH溶液,加热,在试管口置一蘸有浓盐酸的玻璃棒,若有白烟产生,则证明含有NH4+;(2).反应①之前先要洗涤滤渣B,其目的是为了除去表面的杂质离子Fe3+、Fe2+;(3)由于Ce4+有较强氧化性反应,而H2O2有还原性,在酸性条件下反应。因此①的化学方程式2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,得到含有Ce3+的溶液。(4)滴定时所用定量仪器滴定管的读数精确为0.01ml; 若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则消耗的FeSO4溶液体积偏大,测定的该Ce(OH)4产品的质量分数就偏高;(5)第一份加入NaOH足量得到的固体Fe(OH)2, 烘干灼烧至恒重得到1.60g固体是Fe2O3。n(Fe2O3)="1.6g" ÷160 g/mol =0.01mol.n(Fe)=0.02mol;第二份中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应,则产生BaSO4沉淀。n(SO42-)=0.1L×0.5mol/L=0.05mol,根据电荷守恒可得n(NH4+)×1+0.02mol×3=0.05mol×2,解得n(NH4+)=0.04mol.n(H2O)= (7.00g-0.04mol×17g/mol-0.02mol×56g/mol-0.05mol× 96g/mol)÷ 18 g/mol =0.02mol.所以该晶体中n(Fe3+): n(NH4+): n(SO42-): n(H2O)="0.02:0.04:0.05:0,02=2:4:" 5:2.因此该晶体的化学式为Fe2(SO4)3·2(NH4)2SO4·2H2O。
考点:考查混合物的分离方法、NH4+的检验、实验操作的目的、化学方程式的书写、滴定法在物质组成测定中的应用的知识。

(15分)
某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
| 操作 | 现象 |
 a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。 a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。 | |
| b.把小块烧红的木炭迅速伸入热的浓硝酸中。 | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
① 碳与浓硝酸的反应,说明浓硝酸具有 性。
② 反应产生的热量会使少量浓硝酸受热分解,产生红棕色气体、一种无色无味的单质气体X和水,气体X的化学式是 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。同学甲认为可能是木炭与气体X反应产生的现象;同学乙猜测NO2可能具有助燃性,木炭能在NO2中燃烧。他们设计了以下实验。
Ⅰ.制取NO2气体。
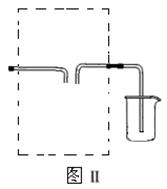
① 在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。

② NaOH溶液的作用是吸收多余的NO2,该反应生成两种物质的量相等的正盐,写出反应的化学方程式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
① 根据实验现象写出碳与NO2气体反应的化学方程式 。
② 试分析是否需要增加带火焰的木炭与纯净的X气体反应的实验 。
③ 通过实验探究,你认为甲、乙同学的预测是否合理,请简述理由 。
已知:ICl的熔点为13.90C,沸点为97.40C,易水解,且能发生反应:ICl(l)+ Cl2(g)=ICl3(l)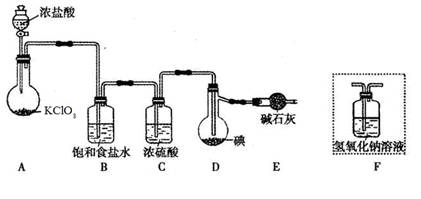
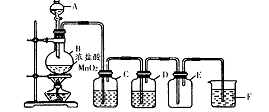
(1)装置A中发生反应的化学方程式是____________ 。
(2)装置B的作用是______。不能用装置F代替装置E,理由____________ 。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是______ (填标号)。
| A.过滤 | B.蒸发结晶 | C.蒸馏 | D.分液 |
①

②ICl+KI=I2+KCl
③I2+2Na2S2O3=2NaI+Na2S4O6
实验1:将5.00g该油脂样品溶于四氯化碳后形成100mL溶液,从中取出十分之一,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol.L-1的Na2S2O3标准溶液滴定。经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL。
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL。
①滴定过程中可用______ 作指示剂。
②滴定过程中需要不断振荡,否则会导致V1______(填“偏大”或“偏小)。
③5.00g该油脂样品所消耗的ICl的物质的量为__mol。由此数据经换算即可求得该油脂的不饱和度。
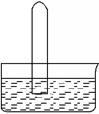
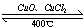 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
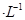 的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。