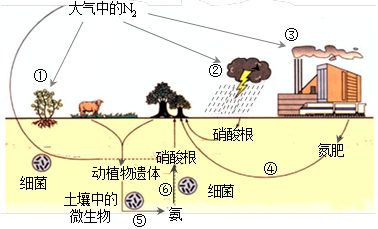
��Ŀ����
��15�֣�
ij�о�С�����о�̼��Ũ����ķ�Ӧ����ʵ��������¡�
| ���� | ���� |
 a���ø���ྻ���ձ�ȡԼ10 mLŨ���ᣬ���ȡ� a���ø���ྻ���ձ�ȡԼ10 mLŨ���ᣬ���ȡ� | |
| b����С���պ��ľ̿Ѹ�������ȵ�Ũ�����С� | ���ȵ�ľ̿���ȵ�Ũ����Ӵ��������ҷ�Ӧ��ͬʱ�д�������ɫ���������Һ����ľ̿Ѹ��ȼ�գ����������� |
�� ̼��Ũ����ķ�Ӧ��˵��Ũ������� �ԡ�
�� ��Ӧ������������ʹ����Ũ�������ȷֽ⣬��������ɫ���塢һ����ɫ��ζ�ĵ�������X��ˮ������X�Ļ�ѧʽ�� ��
��2��ʵ��������Һ����ľ̿Ѹ��ȼ�գ�����������ͬѧ����Ϊ������ľ̿������X��Ӧ����������ͬѧ�Ҳ²�NO2���ܾ�����ȼ�ԣ�ľ̿����NO2��ȼ�ա��������������ʵ�顣
��.��ȡNO2���塣
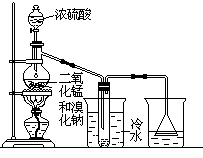
�� �����߿��ڻ�����ͭ��Ũ������ȡ���ռ�NO2��װ�ü�ͼ(�г�������)��
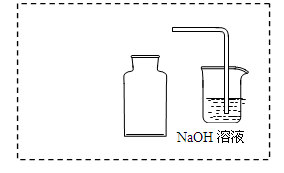
�� NaOH��Һ�����������ն����NO2���÷�Ӧ�����������ʵ�����ȵ����Σ�д����Ӧ�Ļ�ѧ����ʽ ��
��.̽��ʵ�顣
ʵ��������ڿ�������ȼľ̿��ʹ��ȼ�ղ����л��棬���������ľ̿����ʢ��NO2����ļ���ƿ�С�
ʵ������ľ̿��NO2�����г���ȼ�գ�����Ѹ�ٱ���������ƿ��������ɫ��dzֱ����ɫ��������������ʹ����ʯ��ˮ����ǣ�������������ɫ��
�� ����ʵ������д��̼��NO2���巴Ӧ�Ļ�ѧ����ʽ ��
�� �Է����Ƿ���Ҫ���Ӵ������ľ̿�봿����X���巴Ӧ��ʵ�� ��
�� ͨ��ʵ��̽��������Ϊ�ס���ͬѧ��Ԥ���Ƿ��������������� ��
��15�֣���ͼ3�֣�����ÿ��2�֣�
��1���� ǿ������ �� O2
��2�����
���������ܽ������̶Ը�1�֣�©����1�֣�
�� 2NO2 + 2NaOH  NaNO2 + NaNO3 + H2O������1�֣���ƽ1�֣�
NaNO2 + NaNO3 + H2O������1�֣���ƽ1�֣�
��� 2NO2 + 2C��ȼ N2 + 2CO2������1�֣���ƽ1�֣�
�� ��ľ̿ȼ��ʱ����ϵ������Ũ�ȵ��ڿ���������Ũ�ȣ����Բ��ò���ľ̿�ڴ���
��ȼ�յ�ʵ�顣����Ҫ����֣�
�� ��Ҫ�Ǻ�NO2��ȼ�շ�Ӧ��Ҳ�ᷢ����������ȼ�շ�Ӧ����Ϊ������������ڡ�����Ҫ����֣�
���������������1����̼��Ũ����ķ�Ӧ��˵��Ũ�������ǿ�����ԣ�
�� ����������ԭ��Ӧ��Ԫ�صĻ��ϼ������н���ԭ����ɫ�����Ƕ���������NԪ�صĻ��ϼ۽��ͣ���HԪ�صĻ��ϼ�������ߣ���������������ֻ����OԪ�صĻ��ϼ����ߣ���ˣ���ɫ����X��O2��
��2�����ͭ��Ũ������ȡ��������������ȣ�����ƿ�ͷ�Һ©�����ɣ������������ܶȴ��ڿ����������������������ռ�NO2�������ܳ����̳���װ����ͼ
��NaOH��Һ�����������ն����NO2���÷�Ӧ�����������ʵ�����ȵ����Σ��������ηֱ��������ƺ��������ƣ���ѧ����ʽΪ2NO2 + 2NaOH  NaNO2 + NaNO3 + H2O��
NaNO2 + NaNO3 + H2O��
��. ��ľ̿��NO2�����г���ȼ�գ�����Ѹ�ٱ���������ƿ��������ɫ��dzֱ����ɫ��������������ʹ����ʯ��ˮ����ǣ�˵��̼��NO2���巴Ӧ���ɶ�����̼����ɫ���嵪������ѧ����ʽΪ
2NO2 + 2C��ȼ N2 + 2CO2
�ڵ�ľ̿ȼ��ʱ����ϵ������Ũ�ȿ϶����ڿ���������Ũ�ȣ�ʵ������˵������Ѹ�ٱ���������̼��������Ӧ�Ľ�������Բ��ò���ľ̿�ڴ�����ȼ�յ�ʵ�顣
��ľ̿�����Ļ����Ƕ���������Ũ�ȴ���������Ũ�ȣ����Գ��ֻ���Ѹ�ٱ�����������Ҫ��ľ̿��NO2��ȼ�շ�Ӧ��Ҳ�ᷢ����������ȼ�շ�Ӧ����Ϊ������������ڡ�
���㣺�����ʵ������ķ������������������Ļ�ѧ����ʽ���ж�����д��װ��ͼ����ƣ��������ʵ��ж�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д���Ԫ���ж��ֻ��ϼۣ����γɶ��ֻ����
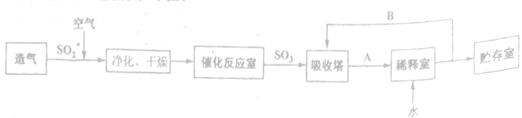
��1����������1 mol��L��1 100 mL NaOH��Һǡ����ȫ����0.1 mol SO2���壬�˷�Ӧ�����ӷ���ʽΪ ������ҺpH_______7(�=����>������)��
��2��ijͬѧ�ڳ������������ʵ������̽��Na2S2O3�Ļ�ѧ���ʡ�
ʵ��ٿ�˵��________(����ĸ)
| A����Na2S2O3��Һ��ˮ�����c(OH��)=10��8mol/L |
| B��H2S2O3��һ������ |
| C��Na2S2O3��һ��������� |
| D��Na2S2O3ˮ�ⷽ��ʽΪS2O32��+2H2O=H2S2O3+2OH�� |
��3��ʵ�����Ƶõ�Na2S2O3�־��������������������ʡ�Ϊ�˲ⶨ�ֲ�Ʒ��Na2S2O3��5H2O(Ħ������Ϊ248g/mol)�ĺ�����һ�������������������KMnO4��Һ�ζ��ķ���(�ٶ��ֲ�Ʒ������������KMnO4��Һ����Ӧ)����ȡ1.28 g�Ĵ���Ʒ����ˮ����0.40mol/L KMnO4��Һ(�������������ữ)�ζ�������Һ��S2O32��ȫ��������ʱ������KMnO4��Һ���20.00 mL��(��֪��5S2O32��+8MnO4��+14H+=8Mn2++10SO42��+7H2O)��
�Իش�
��KMnO4��Һ���ڡ���(���ʽ����ʽ��)�ζ����У��ζ��յ������Ϊ ��
�����ζ�ʱ����֣��տ�����Һ�ֲ���ɫ��ֹͣ�ζ������ʹ��Ʒ��Na2S2O3��5H2O�����������IJ������_____________(�ƫ�ߡ���ƫ�͡����䡱)��
�۲�Ʒ��Na2S2O3��5H2O����������Ϊ ��
 2NO
2NO CaCl2+2NH3��+2H2O
CaCl2+2NH3��+2H2O
 H��+Cl��+ HClO����ƽ�ⳣ������ʽΪK�� ��
H��+Cl��+ HClO����ƽ�ⳣ������ʽΪK�� ��
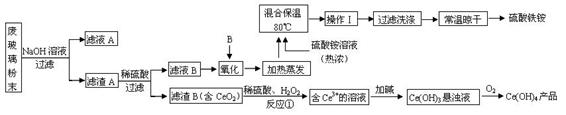
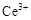 ��
��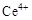 ������Ҫ������ʽ��
������Ҫ������ʽ��
 Na2SO4+MnSO4+Br2��+2H2O
Na2SO4+MnSO4+Br2��+2H2O