��Ŀ����
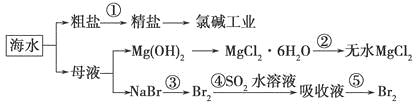
����Ŀ��������أ�K2FeO4����һ�ּ�������������������һ������Ͷ��ˮ������������������ �ȶ��Բ�Ʊ�������ʪ�����ɷ����֣���ԭ�����±���ʾ��
ʪ���������������£�
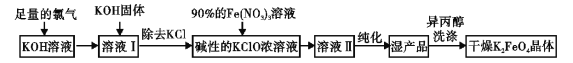
�ش��������⣺
��1��K2FeO4 ��Fe�Ļ��ϼ� ��ʵ���Ҹɷ��Ʊ���ѡ�õ�������
A�������� B�������� C������������ D���մ�����
(2)���¶Ƚϸ�ʱKOH��Cl2��Ӧ���ɵ���KClO3��д�����¶Ƚϸ�ʱKOH��Cl2��Ӧ�Ļ�ѧ����ʽ
___________________��
��3������Һ I �м���KOH �����Ŀ����
A��ʹ KClO3 ת��Ϊ KClO
B��Ϊ��һ����Ӧ�ṩ���ԵĻ���
C��KOH �����ܽ���ȣ���������߷�Ӧ����
D������Һ I �й����� Cl2 ������Ӧ�����ɸ���� KClO
��4����������ǿ��Ũ��Һ�м��� 90%�� Fe��NO3��3��������Ӧ�����ӷ���ʽΪ��
�� Fe3��+3OH���TFe(OH)3���� ��
��5�����������������ˮϴ��ʪ��Ʒ������ϴȥ�����⣬���ŵ��� ��
��6������ж� K2FeO4 �����Ѿ�ϴ�Ӹɾ� ��
��7��������أ�K2FeO4����Ϊˮ���������ŵ�֮һ���ܳ�ȥ�������ʣ���ƽ�÷�Ӧ�����ӷ���ʽ��
____FeO42��+ H2O= Fe��OH��3�����壩+ O2��+ �� ��
���𰸡���1��+6��B
��2��6KOH+3Cl2=KClO3+5KCl+3H2O��3��BD
��4��2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
��5������K2FeO4����ϴ��ʱ��Ʒ����ʧ�Ҳ�Ʒ����
��6��ȡ�������һ�ε�ϴ��Һ���Թ��У�������������Һ���ް�ɫ�������ѱ�ϴ��
��7��4FeO42-+10H2O��4Fe��OH��3�����壩+3O2��+8OH-
��������
�����������1�������������л��ϼ۴�����Ϊ0��֪�����������Ԫ�ػ��ϼ���+6����A��ʵ���Ҹɷ��Ʊ����ü�KOH������������������A����B���������������������������ز���Ӧ��B��ȷ��C�������������ܺ��������Ʒ�Ӧ����ƫ�����ƣ�C����D���մ��������ж������裬���������ܺ��������Ʒ�Ӧ��D����ѡB��
��2������Ŀ��Ϣ��������ԭ��Ӧ�л��ϼ۷����仯ȷ�������У�KClO3��KCl��H2O��Cl2�������������ǻ�ԭ�������ݵ��ӵ�ʧ�غ�������غ�����ƽ���ɵ�6KOH+3Cl2=KClO3+5KCl+3H2O��
��3��A��KClO3ת��Ϊ KClO�����ϼ�ֻ����������ʵ�֣�A����B����������Ҫ�������������Լ�Ҫ������Ϊ��һ����Ӧ�ṩ���ԵĻ�����B��ȷ��C��KOH������Һ���ȣ��¶Ƚϸ�ʱKOH��Cl2��Ӧ���ɵ���KClO3��������KClO��C����D������������������ͼ����������������������KOH�����������Ӧ����KClO��D��ȷ����ѡBD��
��4������Ŀ��Ϣ��������ԭ��Ӧ�л��ϼ۷����仯ȷ���ҳ���Ӧ�Fe3+��ClO-�������FeO42-��Cl-�����ݵ��ӵ�ʧ�غ�������غ�����ƽ���ɵ�2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O��
��5�������������ˮϴ�Ӳ�Ʒ�������Ʒ�ܽ���ʧ��ͬʱ������ӷ������ڸ��
��6����ֻҪ�������һ�ε�ϴ������Cl-������֤��K2FeO4�����Ѿ�ϴ�Ӹɾ����ʴ�Ϊ�����Թ�ȡ�������һ�ε�ϴ��Һ��������������Һ���ް�ɫ�������ѱ�ϴ����
��7�����ݵ��ӵ�ʧ�غ�������غ�����ƽ���ɵ�4FeO42-+10H2O��4Fe��OH��3�����壩+3O2��+8OH-��

����Ŀ��I.AG����Ԫ���У���F��������Ϊ����������Ԫ�أ����ǵ�ԭ�ӽṹ���������±���ʾ��
Ԫ�� | ԭ�ӽṹ������ |
A | ���γɵ�һ��ͬλ��ԭ���ڿ����п��Ʋ⻯ʯ����� |
B | ��Aͬ���ڣ�������������ˮ��������Ũ��ϡ��Һ����ǿ������ |
C | �ؿ��к�������Ԫ�� |
D | Dԭ�ӵ�����������������Ӳ�����ͬ���ǵؿ��к�����Ľ���Ԫ�� |
E | �䵥����Ҫ�����ڻ�ɽ�ڸ��� |
F | �����г����Ľ���������ij����������д��� |
G | Gԭ����Dԭ��ͬ���ڣ���ԭ�Ӱ뾶��ͬ����Ԫ�������� |
��ش��������⣺
(1)A��Ԫ�����ڱ��е�λ����_______��F��ԭ�ӽṹʾ��ͼ��_____________��
(2)������ʵ��֤��C��E�ķǽ�����ǿ������_____��(�����)
�ٳ����£�C�ĵ��ʳ���̬��E�ĵ��ʳʹ�̬��C����̬�⻯����¶���ǿ��E����̬�⻯����¶��Ԣ�C��E�γɵĻ������У�E�����ۢ�E���⻯��ķе������C���⻯��ķе�
(3)��A��B��C����Ԫ������Ԫ�����γɵ�������������Ŀ֮��Ϊ1��1�����ӻ�������______(�ѧʽ)����������NaOH��Һ�ڼ���ʱ��Ӧ�����ӷ���ʽΪ��_______��
(4)A���⻯���ж��֣�1 molA��ij���⻯������к���14mol���ӣ���д�����⻯��ĵ���ʽ��______����֪��25�桢101kPa�£�1g���⻯����������������ȫȼ������Һ̬ˮʱ�ų�������Ϊ40kJ��д�����⻯��ȼ���ȣ�_________��
II.�ס��ҡ���������Ϊ����Ԫ�����γɵ����ʣ����ǵ��ʡ�����֮�������µķ�Ӧ��ϵ��
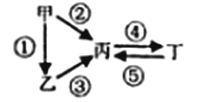
(1)����Ϊ����ɫ���壬�ڢ۷�Ӧ���õ�ͬһ��Һ̬�⻯������ʳ�����ʳƷ��ҵ����������ѧ����������________��д���ҡ����Ļ�ѧ����ʽ��__________��
(2)��������ʾ������ԣ��ڢ۷�Ӧ��Ҫ�Ï�����Һ���ܷ�Ӧ��ͨ������ġ�����������ЧӦ����Ҫ���塣д�������������ӷ���ʽ��__________�������£����ɶ������γɵ�ˮ��Һ�м�����Ũ��Ϊ1.3��10-6 mol��L-1�������Һ��pHΪ______��
(����KspΪ1.3��10-33)