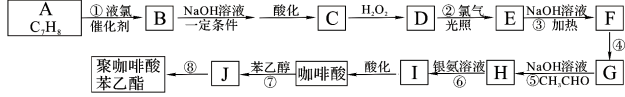
��Ŀ����
����Ŀ����ʽ̼��ͭ��һ����;�㷺�Ļ���ԭ�ϣ��������ֳ����ľ�ˮ����ijУ��ѧ��ȤС��̽����һ������ʯ���д����Ʊ���ʽ̼��ͭ���������Ӷ�ʵ�ֱ��Ϊ�����������ϣ��ÿ�ʯ�ɷ�Ϊ��Al2Fe4CuSi2O13���û�ѧС���ƶ�������������:

��֪��Cu2+����������Ũ��ˮ�п��γ�ͭ����Һ��Cu2+��4NH3��H2O![]() Cu(NH3)42++4H2O
Cu(NH3)42++4H2O
�ش��������⣺
��1����Al2Fe4CuSi2O13��д����������ʽ___________��
��2��Ϊ�˲�������������ʣ��ɲ�ȡ��ʩ��________,_________����д���֣���
��3��д����������ӷ���ʽ__________��
��4���ô�����2���������Ⱥ����_____��____�����Լ�����ʹ��˳����д��ѧʽ����
��5���ڲ�����У����ȼ�K2CO3��Һ�����KOH��Һ��������
CuCO3(s)+2OH-(aq) ![]() Cu(OH)2(s)+CO32-(aq)����÷�Ӧƽ�ⳣ��Ϊ��______������֪��Ksp(CuCO3=2.4��10-10��Ksp(Cu(OH)2=2.2��10-20����
Cu(OH)2(s)+CO32-(aq)����÷�Ӧƽ�ⳣ��Ϊ��______������֪��Ksp(CuCO3=2.4��10-10��Ksp(Cu(OH)2=2.2��10-20����
��6��Ϊ�˼���ü�ʽ̼��ͭ���ȣ���С���ȡ25g��Ʒ�����뵽100mL 3mol/L�������н����ܽ⡣��ַ�Ӧ�����ų�CO2����ȴ��ȡ��10mL���μ�2�μ��ȣ�Ȼ����2mol/L��KOH��Һ���еζ�������ȥ5mL������Ʒ�Ĵ���Ϊ_________
���𰸡� Al2O3��2FeO��Fe2O3��CuO��2SiO2 �����ʯ ���ȡ�������Ũ�ȡ����� Cu(NH3)42+ +4H+ ��Cu2+ +4NH4+ KOH H2SO4 1.09��1010 44.4%
����������1���������ʵĻ�ѧʽAl2Fe4CuSi2O13��֪��д������������ʽΪAl2O3��2FeO��Fe2O3��CuO��2SiO2����2��Ϊ�˲�������������ʣ��ɲ�ȡ��ʩ�з����ʯ�����ȡ�������Ũ�ȡ�����ȣ���3���������������Ϊ��������Һ1�к��н��������ӣ�����˫��ˮ�����������ӣ����백ˮ���������ӡ������ӣ�������֪��Ϣ��֪ͭ����ת��ΪCu(NH3)42+�����Բ�������ӷ���ʽΪCu(NH3)42++4H+��Cu2++4NH4+����4���ô�����2�к��������������������������������������������������ת��Ϊ�������Ⱥ����KOH��H2SO4�����Լ�����5��CuCO3(s)+2OH-(aq) ![]() Cu(OH)2(s)+CO32-(aq)�÷�Ӧƽ�ⳣ��Ϊ
Cu(OH)2(s)+CO32-(aq)�÷�Ӧƽ�ⳣ��Ϊ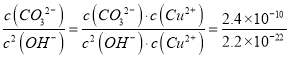 ��1.09��1010����6��ʣ����������ʵ�����2mol/L��0.005L��0.01mol�������ʽ̼��ͭ��Ӧ�����0.3mol-0.01mol��100mL/10mL��0.2mol������Cu2CO3(OH)2��4HCl��֪��ʽ̼��ͭ�����ʵ�����0.05mol�������Ʒ�Ĵ���Ϊ
��1.09��1010����6��ʣ����������ʵ�����2mol/L��0.005L��0.01mol�������ʽ̼��ͭ��Ӧ�����0.3mol-0.01mol��100mL/10mL��0.2mol������Cu2CO3(OH)2��4HCl��֪��ʽ̼��ͭ�����ʵ�����0.05mol�������Ʒ�Ĵ���Ϊ![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��(12��)�±�Ϊ��ʽ���ڱ���һ���֣����еı�Ŵ�����Ӧ��Ԫ�ء�
�� | |||||||||||||||||
�� | �� | ||||||||||||||||
�� | �� | �� | [ | �� | |||||||||||||
�� | �� | �� |
��ش��������⣺
(1)��������d��Ԫ�ص��� (��Ԫ�ط���)��
(2)����Ԫ������6��ԭ����Ԫ������6��ԭ���γɵ�ij�ֻ�״��������Ϊ ���������γɵ�һ�ֳ����ܼ��Ļ�ѧʽΪ �������幹��Ϊ________________��
(3)ijԪ��ԭ�ӵ���Χ�����Ų�ʽΪnsnnpn+1����Ԫ��ԭ�ӵ�������Ӳ��Ϲµ��Ӷ���Ϊ ����Ԫ����Ԫ�����γɵ������X���� ����(���������������Ǽ�����)��
(4)Ԫ�����ĵ�һ������ Ԫ����(ѡ������������������������)�ĵ�һ�����ܣ�Ԫ�����ĵ縺�� Ԫ����(ѡ������������������������)�ĵ縺�ԡ�
(5)Ԫ���������γɵĻ�����ĵ���ʽΪ ��
(6)Ԫ�����Ļ�̬ԭ�Ӻ�������Ų�ʽ���������� ��������������
(7)ijЩ��ͬ��Ԫ�ص�����Ҳ��һ���������ԣ����ϱ���Ԫ������Ԫ�������������������Ƶ����ʡ���д��Ԫ����������������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��
_______________________________________________��