��Ŀ����
����Ŀ��ij��ѧС����̽��NO![]() �������Լ��仹ԭ���
�������Լ��仹ԭ���
(1)�������
��ͬѧ��Ϊֻ����Һ��ͬʱ����H+ʱ��NO![]() ����������;
����������;
��ͬѧ���ɼ�ͬѧ�۵㣬����ΪNO![]() �����;��������ԣ�������__________
�����;��������ԣ�������__________
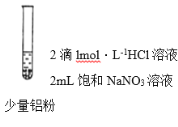
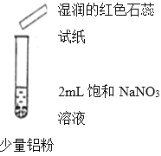
(2)ʵ��̽����С��ͬѧΪ����������ۣ���Ʋ�����������ʵ��
ʵ��I | ʵ��II | ʵ��III | |
���� |
|
|
|
���� | �ȣ�������ɫ���ݣ���Һ���Ϸ���Ϊdz����ɫ����Ĵָ��ס�Թܿ�Ƭ�̣������ƾ��ƻ��棬û�б������� | �ȣ�������ɫ���ݣ�ʪ��ĺ�ɫʯ����ֽ��������Ĵָ��ס�Թܿ�Ƭ�̣������ƾ��ƻ��棬û�б������� | �ȣ�������ɫ���ݣ�ʪ��ĺ�ɫʯ����ֽ��������Ĵָ��ס�Թܿ�Ƭ�̣������ƾ��ƻ��棬û�б������� |
��ʵ��I�з�Ӧ�����ӷ���ʽΪ_________��
��ʵ��II�μ���������ˮ��Ŀ����__________����������ɫ����Ϊ___________
��ʵ��III��Ӧ���ã�ȡ�ϲ���Һ���μ�ϡ���ᣬ�Ȳ�����ɫ���ǣ�������ʧ����ʵ��III�з�Ӧ�����ӷ���ʽΪ__________��
(3)ʵ�����:��ʵ��I��II��III�ɵó��Ľ�����________��
���𰸡�NO![]() ��N�Ļ��ϼ�Ϊ���+5�����ϼۿ��Խ��� Al+NO
��N�Ļ��ϼ�Ϊ���+5�����ϼۿ��Խ��� Al+NO![]() +4H+
+4H+![]() Al3++NO��+2H2O �ų�����ҺŨ�ȸı�����ĸ��� NH3 (����) 8Al+3NO
Al3++NO��+2H2O �ų�����ҺŨ�ȸı�����ĸ��� NH3 (����) 8Al+3NO![]() +5OH-+2H2O
+5OH-+2H2O![]() 8AlO
8AlO![]() +3NH3�� NO
+3NH3�� NO![]() �����ԡ����ԡ�������Һ�ж��������ԡ���1mol��L-1 H+ (������)��Һ�еĻ�ԭ����ΪNO����������Һ�к�1mol��L-1 OH- (�����)��Һ�еĻ�ԭ����ΪNH3
�����ԡ����ԡ�������Һ�ж��������ԡ���1mol��L-1 H+ (������)��Һ�еĻ�ԭ����ΪNO����������Һ�к�1mol��L-1 OH- (�����)��Һ�еĻ�ԭ����ΪNH3
��������
��ʵ��I�ȣ�������ɫ���ݣ���Һ���Ϸ���Ϊdz����ɫ��˵��������NO���������������������ɺ���ɫ�Ķ�����������Ĵָ��ס�Թܿ�Ƭ�̣������ƾ��ƻ��棬û�б�������˵��û�в����������������������±����������������������Ļ�ԭ����ΪNO��Al+NO![]() +4H+
+4H+![]() Al3++NO��+2H2O��
Al3++NO��+2H2O��
��ʵ��II���ȣ�������ɫ���ݣ�ʪ��ĺ�ɫʯ����ֽ������˵���а�����������Ĵָ��ס�Թܿ�Ƭ�̣������ƾ��ƻ��棬û�б�������˵��û�������������������������±����������������������Ļ�ԭ����Ϊ������
��ʵ��III���ȣ�������ɫ���ݣ�ʪ��ĺ�ɫʯ����ֽ������˵���а�����������Ĵָ��ס�Թܿ�Ƭ�̣������ƾ��ƻ��棬û�б�������˵��û������������ʵ��III��Ӧ���ã�ȡ�ϲ���Һ���μ�ϡ���ᣬ�Ȳ�����ɫ���ǣ�������ʧ����ƫ����������ʣ�˵������������AlO![]() ����ʵ��III�з�Ӧ�����ӷ���ʽΪ8Al+3NO
����ʵ��III�з�Ӧ�����ӷ���ʽΪ8Al+3NO![]() +5OH-+2H2O
+5OH-+2H2O![]() 8AlO
8AlO![]() +3NH3����˵���ڼ�����������������������ԣ�������Ļ�ԭ����Ϊ������
+3NH3����˵���ڼ�����������������������ԣ�������Ļ�ԭ����Ϊ������
�ܽ��ۣ�NO![]() �����ԡ����ԡ�������Һ�ж��������ԡ�������ͬ����ԭ���ﲻͬ��
�����ԡ����ԡ�������Һ�ж��������ԡ�������ͬ����ԭ���ﲻͬ��
(1)��ͬѧ���ɼ�ͬѧ�۵㣬����ΪNO![]() �����;��������ԣ�������NO
�����;��������ԣ�������NO![]() ��N�Ļ��ϼ�Ϊ���+5�����ϼۿ��Խ��ͣ��ʴ�Ϊ��NO
��N�Ļ��ϼ�Ϊ���+5�����ϼۿ��Խ��ͣ��ʴ�Ϊ��NO![]() ��N�Ļ��ϼ�Ϊ���+5�����ϼۿ��Խ��ͣ�
��N�Ļ��ϼ�Ϊ���+5�����ϼۿ��Խ��ͣ�
(2)��ʵ��I�ȣ�������ɫ���ݣ���Һ���Ϸ���Ϊdz����ɫ��˵��������NO���������������������ɺ���ɫ�Ķ�����������Ĵָ��ס�Թܿ�Ƭ�̣������ƾ��ƻ��棬û�б�������˵��û�в����������������������±�������������������������ԭΪNO��ʵ��I�з�Ӧ�����ӷ���ʽΪAl+NO![]() +4H+
+4H+![]() Al3++NO��+2H2O���ʴ�Ϊ��Al+NO
Al3++NO��+2H2O���ʴ�Ϊ��Al+NO+4H+
![]() Al3++NO��+2H2O��
Al3++NO��+2H2O��
��ʵ��II���ȣ�������ɫ���ݣ�ʪ��ĺ�ɫʯ����ֽ������˵���а�����������Ĵָ��ס�Թܿ�Ƭ�̣������ƾ��ƻ��棬û�б�������˵��û�����������������������£�������Ļ�ԭ����Ϊ������ʵ��II�μ���������ˮ��Ŀ�����ų�����ҺŨ�ȸı�����ĸ��ţ���������ɫ����ΪNH3 (����)���ʴ�Ϊ���ų�����ҺŨ�ȸı�����ĸ��ţ�NH3 (����)��
��ʵ��III���ȣ�������ɫ���ݣ�ʪ��ĺ�ɫʯ����ֽ������˵���а�����������Ĵָ��ס�Թܿ�Ƭ�̣������ƾ��ƻ��棬û�б�������˵��û������������˵���ڼ��������£�������Ļ�ԭ����Ϊ������ʵ��III��Ӧ���ã�ȡ�ϲ���Һ���μ�ϡ���ᣬ�Ȳ�����ɫ���ǣ�������ʧ����ƫ����������ʣ�˵������������AlO![]() ����ʵ��III�з�Ӧ�����ӷ���ʽΪ8Al+3NO
����ʵ��III�з�Ӧ�����ӷ���ʽΪ8Al+3NO![]() +5OH-+2H2O
+5OH-+2H2O![]() 8AlO
8AlO![]() +3NH3�����ʴ�Ϊ��8Al+3NO
+3NH3�����ʴ�Ϊ��8Al+3NO![]() +5OH-+2H2O
+5OH-+2H2O![]() 8AlO
8AlO![]() +3NH3����
+3NH3����
(3)ʵ�����:��ʵ��I��II��III�ɵó��Ľ�����NO![]() �����ԡ����ԡ�������Һ�ж��������ԡ���1mol��L-1 H+ (������)��Һ�еĻ�ԭ����ΪNO����������Һ�к�1mol��L-1 OH- (�����)��Һ�еĻ�ԭ����ΪNH3���ʴ�Ϊ��NO
�����ԡ����ԡ�������Һ�ж��������ԡ���1mol��L-1 H+ (������)��Һ�еĻ�ԭ����ΪNO����������Һ�к�1mol��L-1 OH- (�����)��Һ�еĻ�ԭ����ΪNH3���ʴ�Ϊ��NO![]() �����ԡ����ԡ�������Һ�ж��������ԡ���1mol��L-1 H+ (������)��Һ�еĻ�ԭ����ΪNO����������Һ�к�1mol��L-1 OH- (�����)��Һ�еĻ�ԭ����ΪNH3��
�����ԡ����ԡ�������Һ�ж��������ԡ���1mol��L-1 H+ (������)��Һ�еĻ�ԭ����ΪNO����������Һ�к�1mol��L-1 OH- (�����)��Һ�еĻ�ԭ����ΪNH3��

����Ŀ��ij�¶��£�������ɱ�������з�����Ӧ��2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(l),�ı���ʼʱ��������ʵ������ڲ�ͬѹǿ�´�ƽ��ʱCH3OCH3(g)�����ʵ��������ʾ������˵���������(����)
CH3OCH3(g)+3H2O(l),�ı���ʼʱ��������ʵ������ڲ�ͬѹǿ�´�ƽ��ʱCH3OCH3(g)�����ʵ��������ʾ������˵���������(����)
ѹǿ | P1 | P2 | P3 | |
n/mol | ��2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
��1.0molCO2 3.0molH2 | x 1 | y 1 | z 1 | |
��1.0molCH3OCH3 3.0molH2O | x 2 | y 2 | z 2 | |
A.P1>P2B.x 1=0.05
C.P2�����£�����CH3OCH3ƽ��ת����Ϊ96%D.���÷�Ӧ���Է����У�����¸�����