题目内容
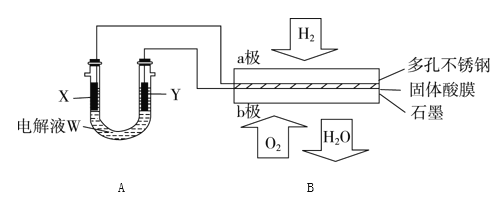
【题目】如图装置所示,是用氢氧燃料电池B进行的某电解实验:
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:Li2NH+H2=LiNH2+LiH,则下列说法中正确的是________。
A. Li2NH中N的化合价是-1
B. 该反应中H2既是氧化剂又是还原剂
C. Li+和H-的离子半径相等
D. 此法储氢和钢瓶储氢的原理相同
(2)在电池B工作时:
①若用固体Ca(HSO4)2为电解质传递H+,则电子由________极流出,H+向______极移动(填“a”或“b ”)。
②b极上的电极反应式为_________。
③外电路中,每转移0.1 mol电子,在a极消耗________ L的H2(标准状况下)。
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
①电解池中X极上的电极反应式是______________。在X极这边观察到的现象是____________。
②检验Y电极上反应产物的方法是______________。
【答案】B a b O2+4H++4e-=2H2O 1.12 2H++2e-=H2↑ 溶液变红 用湿润的KI-淀粉试纸接近Y极气体产物,试纸变蓝,证明产生Cl2
【解析】
(2)燃料电池中通入燃料的一极为负极,通入氧气的一极为正极,燃料电池的反应原理相当于燃料的燃烧,据此书写电极反应式,并根据原电池中电子、离子的移动方向分析解答;
(3)先根据电解池的工作原理确定阴、阳极,再根据阴、阳极的放电顺序书写电极反应式,并分析现象。
(1)A. Li2NH中N的化合价为-3价,故A错误;
B. 反应中H2分别生成LiNH2和LiH,LiNH2中H为+1价,LiH中H的化合价为-1价,则反应中H2既是氧化剂又是还原剂,故B正确;
C. Li+和H-的核外电子排布相同,Li+的核电核数更大,则半径更小,故C错误;
D. 此法储氢是利用氧化还原反应将H2转化为固体材料,发生化学变化,而钢瓶储氢是将氢气液化,为物理变化,原理不同,故D错误;故答案为B;
(2)①装置B为氢氧燃料电池,通入氢气的电极为负极,通入氧气的电极为正极,电池工作时,电子从负极通过外电路流向正极,即从a极流向b极,电解质溶液中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;
②b极为正极,发生还原反应,电极反应式为O2+4e-+4H+=2H2O;
③a极为负极,发生氧化反应,电极反应式为H2-2e-=2H+,每转移2 mol电子消耗1 mol H2,则每转移0.1 mol电子,在a极消耗0.05 mol H2,即1.12 L H2;
(3)氢氧燃料电池中,a极为负极,b极为正极,则电解池中,X极为阴极,Y为阳极,
①X极为阴极,该电极上为水电离出的氢离子发生得电子的还原反应,同时生成氢氧根离子,即2H2O+2e-=H2↑+2OH-,溶液碱性增强,因此滴有酚酞的溶液变红;
②Y极为阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,产物为氯气,检验方式为用湿润的KI-淀粉试纸接近Y极气体产物,试纸变蓝,证明产生Cl2。

【题目】同温同压下,等体积的N2O和CO2两种气体相比较:①质量相等;②所含原子数相等;③所含电子数相等;④所含分子数相等;⑤所含氧原子数相等,上述结论中不正确的是( )
A.③⑤B.②④C.①③D.⑤
【题目】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备锂电池的正极材料LiFePO4。部分工艺流程如下:
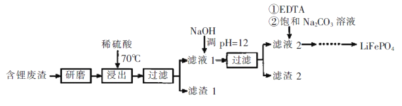
资料:i滤液1、滤液2中部分例子浓度(g·L-1)
Li+ | Ni2+ | Ca2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.08 | 0.78×10-3 |
ii.EDTA能和某些二价金属离子形成稳定的水溶性络合物
iii.某些物质的溶解度(S)
T/℃ | 20 | 40 | 60 | 80 | 100 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
S(Li2SO4)/g | 34.7 | 33.6 | 32.7 | 31.7 | 30.9 |
I.制备Li2CO3粗品
(1)上述流程中为加快化学反应速率而采取的措施是____。
(2)滤渣2的主要成分有____。
(3)向滤液2中先加入EDTA,再加入饱和Na2C03溶液,90℃充分反应后,分离出固体 Li2CO3粗品的操作是_______。
(4)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是________g。(摩尔质量:Li2CO3 74 g.mol4)
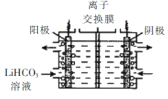
II.纯化Li2CO3粗品
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO31溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是____,该池使用了_________(填“阳”或“阴”)离子交换膜。
Ⅲ.制备 LiFePO4
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是_________。