题目内容
【题目】无机或有机含氧酸分子去掉一个或多个羟基后剩余结构称为酰基,如“—SO2—”称为硫酰(基),SOCl2、SO2Cl2、COCl2分别称为亚硫酰氯、硫酰氯和碳酰氯,它们都有很多相似的性质,如都能发生水解反应生成对应的酸、都可作氯化剂等。回答下列问题:
(1)已知:SO2(g)+PCl5(s) ![]() SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1
SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1
PCl5(s)+H2O(l) ![]() POCl3(l)+2HCl(g) ΔH2=b kJ·mol1
POCl3(l)+2HCl(g) ΔH2=b kJ·mol1
则反应SOCl2(l)+H2O(l) ![]() SO2(g)+2HCl(g) ΔH3=________kJ·mol1(用含a、b的代数式表示)。
SO2(g)+2HCl(g) ΔH3=________kJ·mol1(用含a、b的代数式表示)。

(2)在1 L的密闭容器中充入1 mol SO2和2 mol Cl2,发生反应:SO2(g)+Cl2(g)![]() SO2Cl2(l),达平衡后,其他条件不变,减小压强,请在图中画出改变条件后反应速率随时间的变化曲线图。再次达平衡后测得SO2的转化率为35%。反应后向密闭容器中注入足量的BaCl2溶液,最终生成沉淀的质量为___________g。
SO2Cl2(l),达平衡后,其他条件不变,减小压强,请在图中画出改变条件后反应速率随时间的变化曲线图。再次达平衡后测得SO2的转化率为35%。反应后向密闭容器中注入足量的BaCl2溶液,最终生成沉淀的质量为___________g。
(3)一定条件下存在反应:CO(g)+Cl2(g) ![]() COCl2(g) ΔH=108 kJ·mol1,现有3个体积均为10 L的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在150℃条件下开始反应达平衡。
COCl2(g) ΔH=108 kJ·mol1,现有3个体积均为10 L的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在150℃条件下开始反应达平衡。
1 mol CO、1 mol Cl2 |
Ⅰ绝热恒容
1 mol COCl2 |
Ⅱ恒温恒容
1 mol CO、1 mol Cl2 |
Ⅲ恒温恒容
①容器Ⅰ中CO的转化率与容器Ⅱ中COCl2的转化率之和_________(填“>”“<”或“=”)1。②容器Ⅲ中反应前总压强为1 atm,反应后的总压强为0.75 atm,则反应的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】(1)ba
(2)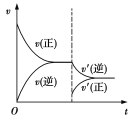 233 (3)①< ② 4 atm1
233 (3)①< ② 4 atm1
【解析】(1)SO2(g)+PCl5(s)![]() SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1 ①
SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1 ①
PCl5(s)+H2O(l)![]() POCl3(l)+2HCl(g) ΔH2=b kJ·mol1 ②
POCl3(l)+2HCl(g) ΔH2=b kJ·mol1 ②
反应①反应②得SO2(g)+2HCl(g) ![]() SOCl2(l)+H2O(l),ΔH=ΔH1ΔH2=(ab) kJ·mol1。因此有ΔH3=(ΔH1ΔH2)=(ba) kJ·mol1。
SOCl2(l)+H2O(l),ΔH=ΔH1ΔH2=(ab) kJ·mol1。因此有ΔH3=(ΔH1ΔH2)=(ba) kJ·mol1。
(2)由于生成物中只有液态的SO2Cl2,因此减小压强的瞬间逆反应速率不变,正反应速率减小,平衡逆向移动。反应后注入足量BaCl2溶液的过程中发生的相关反应有SO2Cl2+2H2O![]() H2SO4+2HCl,SO2+Cl2+2H2O
H2SO4+2HCl,SO2+Cl2+2H2O![]() H2SO4+2HCl,H2SO4+BaCl2
H2SO4+2HCl,H2SO4+BaCl2![]() BaSO4↓+2HCl,由硫元素守恒得n(BaSO4)=1 mol,质量为233 g。
BaSO4↓+2HCl,由硫元素守恒得n(BaSO4)=1 mol,质量为233 g。
(3)①若装置Ⅰ为恒温恒容,则转化率之和等于1,由于装置Ⅰ绝热,而该反应是放热反应,随着反应进行温度升高不利于CO转化,因此两者之和小于1。 ②根据压强之比等于物质的量之比可知反应后容器内气体的物质的量为1.5 mol,可知平衡后n(CO)=n(Cl2)= n(COCl2)= 0.5 mol,平衡分压各为0.25 atm,Kp=![]() =4 atm1。
=4 atm1。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】下表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 向沸腾的蒸馏水中滴加饱和FeCl3溶液至溶液变红褐色:Fe3++3H2O=Fe(OH)↓+3H+ | 正确 |
B | 大理石溶于醋酸的反应: CaCO3+2H+=Ca2++CO2↑+H2O | 错误:CH3COOH写化学式,CaCO3写离子式 |
C | 铁与稀盐酸反应: Fe2++6H+=2Fe3++3H2↑ | 错误:产物不符合客观事实 |
D | NaOH与少量的CO2反应:OH-+CO2=HCO3- | 正确 |
A. A B. B C. C D. D

