题目内容
氢气是一种高能、清洁的能源,且是重要的工业原料.煤的气化过程存在如下反应:
CO(g)+H2O(g)
CO2(g)+H2(g)△H<0
反应达到平衡后,采用如下措施可提高CO转化率的是( )
CO(g)+H2O(g)
| 催化剂 |
反应达到平衡后,采用如下措施可提高CO转化率的是( )
| A.更换高效催化剂 | B.增大CO的浓度 |
| C.降低温度 | D.增大压强 |
A、催化剂不能使化学平衡移动,无法提高CO的转化率,故A故错;
B、增大CO的浓度,平衡是向着正向移动,但是转化CO的远没有剩余的多,转化率反而降低,故B故错;
C、该反应为放热反应,降低温度,平衡性在放热的正向移动,提高了CO的转化率,故C正确;
D、反应前后气体的体积无变化,改变压强平衡不移动,故D错误;
故选C.
B、增大CO的浓度,平衡是向着正向移动,但是转化CO的远没有剩余的多,转化率反而降低,故B故错;
C、该反应为放热反应,降低温度,平衡性在放热的正向移动,提高了CO的转化率,故C正确;
D、反应前后气体的体积无变化,改变压强平衡不移动,故D错误;
故选C.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)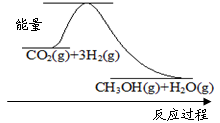
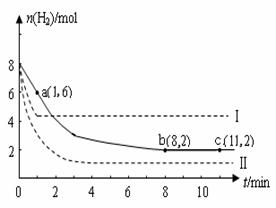
 CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)反应时间t的变化曲线如图所示,下列说法正确的是( )
CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)反应时间t的变化曲线如图所示,下列说法正确的是( )
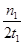 mol·L-1·min-1
mol·L-1·min-1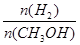 减小
减小