题目内容
【题目】对下列图像的描述正确的是
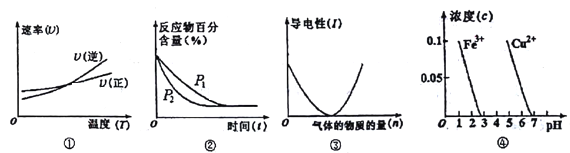
A. 根据图①判断反应A2(g)+3B2(g) ![]() 2AB3(g)的 △H>0
2AB3(g)的 △H>0
B. 图②可表示压强(P)对反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
C. 图③可表示向醋酸溶液通入氨气时,溶液导电性随氨气量的变化
D. 根据图④,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
【答案】D
【解析】A、根据图①可知,交点之前,反应未达平衡,交点时处于平衡状态,交点后升高温度逆反应速率增大比正反应速率增大更多,平衡向逆反应移动,升高温度平衡向吸热反应移动,故可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)正反应是放热反应,故A错误;B、由图②可知,P2到达平衡时间短,说明压强P2>P1,平衡时反应物的转化率不变,因此反应前后气体的体积不变,与可逆反应2A(g)+2B(g)
2AB3(g)正反应是放热反应,故A错误;B、由图②可知,P2到达平衡时间短,说明压强P2>P1,平衡时反应物的转化率不变,因此反应前后气体的体积不变,与可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)不符,故B错误;C、醋酸是弱电解质,向醋酸中通入氨气,醋酸和氨气反应生成强电解质醋酸铵,溶液中离子浓度增大,导电性增强,故C错误;D、由图可知,Fe3+在pH=3左右沉淀完全,此时铜离子不沉淀,pH=5时Cu2+开始沉淀,故可以加入适量CuO,调节pH值至3~5,使铁离子转变成氢氧化铁沉淀,除去CuSO4溶液中的Fe3+,不引入杂质,故D正确;故选D。
3C(g)+D(s)不符,故B错误;C、醋酸是弱电解质,向醋酸中通入氨气,醋酸和氨气反应生成强电解质醋酸铵,溶液中离子浓度增大,导电性增强,故C错误;D、由图可知,Fe3+在pH=3左右沉淀完全,此时铜离子不沉淀,pH=5时Cu2+开始沉淀,故可以加入适量CuO,调节pH值至3~5,使铁离子转变成氢氧化铁沉淀,除去CuSO4溶液中的Fe3+,不引入杂质,故D正确;故选D。

【题目】某研究性学习小组通过测量溶液的电导率(电导率越大,说明溶液的导电能力越强)探究沉淀溶解平衡,各物质的电导率数据如下:
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
物质 |
固体 |
|
饱和溶液 |
饱和溶液 |
NaCl溶液 |
|
饱和溶液 |
电导率 | 0 | 7 | 37 | 389 | 1989 | 1138 | 13 |
下列分析不正确的是
A. ![]() 固体中不存在自由移动的离子
固体中不存在自由移动的离子
B. 与①、②对比,可说明③中![]() 发生了电离
发生了电离
C. ⑤、⑥等体积混合后过滤,推测滤液的电导率一定大于13
D. 将①中固体加入④中,发生反应:![]()