题目内容
【题目】(1)下列气态分子BCl3、CCl4、H2O和BeCl2中,其键角由大到小的顺序为________。
(2)硫化氢(H2S)分子的空间构型为________;二氧化碳(CO2)分子的空间构型为________;甲烷(CH4)分子的空间构型为________。
(3)由于氨水和次氯酸盐溶液在弱碱性介质中反应可生成氯胺(H2NCl),分子结构类似于NH3,H2NCl分子的空间构型为________,电子式为________,H2NCl中氯的化合价为________。
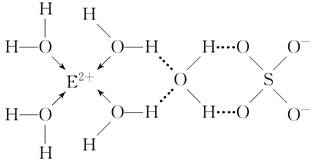
【答案】 BeCl2>BCl3>CCl4>H2O V形 直线形 正四面体形 三角锥形 ![]() -1价
-1价
【解析】本题主要考查分子的空间构型。
BeCl2、BCl3、CCl4、H2O的空间构型分别是直线形(键角180°)、平面正三角形(键角120°)、正四面体型(键角109°28′)、V形(存在两对孤电子对,键角小于109°28′)。NH3的空间构型是三角锥形,H2NCl分子结构与其类似,二者构型应当类似;分子中N与H以及Cl以共用电子对成键,N与Cl都满足8电子稳定结构,可写出分子的电子式;Cl比N吸引电子能力强,共用电子对偏向Cl,Cl的化合价是-1价。

练习册系列答案
相关题目