题目内容
(10分)计算填空:
(1)(2分)1mol某金属单质与足量的H2SO4反应,放出1.5molH2(标况下)并转化为具有Ne原子的电子层结构的离子,则该金属在周期表的位置 。
(2)(6 分)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
_
aA (g)+ bB (g)  2C(g)
2C(g)
起始物质的量(mol): 3 2 0
2s末物质的量浓度(mol/L): 0.9 0.8 0.4
则①a= ,b= ;
②2S内B的反应速率= 。
(3)(2分) 1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。

(1)第三周期第ⅢA族(2分)
(2)①a=3(2分) b=1 (2分) ②0.1mol/(L·S)(2分)
(3)NO2(g) + CO(g) = CO2(g) + NO(g) △H = - 234kJ·mol-1(2分)
【解析】(1)1.5mol氢气,共转移电子是1.5mol×2=3.0mol,所以该金属原子在反应中失去3铬电子。由于离子具有氖原子的电子层结构,因此金属的原子序数为13,即为铝元素,位于第三周期第ⅢA族。
(2)根据方程式可知A、B、C的浓度变化量分别是(mol/L)0.6、0.2、0.4,所以化学计量数之比为3︰1︰2,因此a=3,b=1。B的平均反应速率是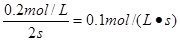 。
。
(3)根据图像可知,反应物的总能量高于生成物的总能量,所以是放热反应,反应热为134 kJ·mol-1-368 kJ·mol-1=- 234kJ·mol-1,所以反应的热化学方程式为NO2(g) + CO(g) = CO2(g) + NO(g) △H = - 234kJ·mol-1。



 +2H2O
+2H2O
