题目内容
【题目】X、Y、Z、W为短周期的主族元素,其原子序数依次增大。X元素形成的单质是自然界中含量最多的气体,Y是电负性最大的元素,W的原子最外层电子数与核外电子总数之比为3︰8,X的原子序数是Z的原子序数的一半,U是第四周期11列元素。
(1)U基态原子的价电子排布式__________________,Z在周期表中位置为___________________。
(2)在OY2中,氧原子的杂化轨道类型是____________。
(3)Z、W的最高价氧化物的水化物,酸性较强的是______。(填最高价氧化物的水化物的化学式)
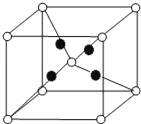
(4)U的含氧化合物M晶胞如图所示(“○”表示氧原子),则M的化学式为________。
(5)已知:[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl﹣取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_____________。
【答案】 3d104s1 第3周期 IVA族 sp3 H2SO4 Cu2O 平面正方形
【解析】X元素形成的单质是自然界中含量最多的气体,X为N.Y是电负性最大的元素,Y是F.W的原子最外层电子数与核外电子总数之比为3:8,若W有两个电子层,设W的最外层电子数为a,则有a:(2+a)=3:8,解得a=1.2,不合题意,舍去.若W有三个电子层,设W的最外层电子数为a,则有a:(10+a)=3:8,解得a=6,W为S.X的原子序数是Z的原子序数的一半,X的原子序数是7,Z为14号的Si,U是第四周期11列元素,即第四周期第ⅠB族元素Cu;
(1)Cu的电子排布式为1S22S22P63S23P63d104S1,外围电子排布式为3d104S1,Z为Si,处于第3周期 IVA族;
(2)OY2为OF2,O的价层电子对为(6+2)/2=4,故氧原子的杂化轨道类型是sp3;
(3)Z、W的最高价氧化物的水化物分别为H2SiO3 、H2SO4,因为S的非金属性强于Si,所以H2SO4的酸性强于H2SiO3;
(4)氧原子位于顶点和体内,每个晶胞占有8×1/8+1=2,铜原子位于体内,每个晶胞占有4个铜原子;
(5)[Cu(NH3)4]2+形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形。

【题目】除去下列物质中混有的少量杂质(括号内为杂质),所用试剂正确的是( )
物质 | 除杂试剂 | |
A | Cl2(HCl) | NaOH溶液 |
B | Fe2O3(Al2O3) | NaOH溶液 |
C | Na2CO3溶液(NaCl) | AgNO3溶液 |
D | Na2SO4溶液(Na2CO3) | 稀盐酸 |
A.A
B.B
C.C
D.D