题目内容
【题目】在10L定容密闭容器中,A、B、C三种气态物质构成了可逆反应的体系,当在某一温度时,A、B、C物质的量与时间的关系如图1,C的百分含量与温度的关系如图2。下列分析不正确的是
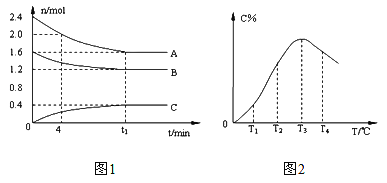
A. t1时刻前,混合气体的密度减小,t1时刻后,混合气体的密度不变
B. 该反应的平衡常数表达式![]()
C. 由T1向T2变化时,V正> V逆
D. 此反应的正反应为放热反应
【答案】A
【解析】A,在恒容条件下,气体总体积不变、气体的总质量也不变,所以气体的密度也不变,所以A不正确。B,分析图1中数据可知,t1时刻反应达到化学平衡状态,从0~t1,A减少了0.8mol,B减少了0.4mol,C增加了0.4mol,因为变化量之比等于化学计量数之比,所以此反应的化学方程式为:2A(g) +B(g)![]() C(g),所以该反应的平衡常数表达式
C(g),所以该反应的平衡常数表达式![]() ,B正确。C,由图2可知,由T1向T2变化时,C的百分含量在增加,说明反应正在向正反应方向进行,所以V正> V逆,所以C正确。T3时C的百分含量达到最高,说明T3之前反应未达化学平衡状态,,T3之后,C的百分含量减少,说明温度升高化学平衡向逆反应方向移动,所以正反应为放热反应,D正确。
,B正确。C,由图2可知,由T1向T2变化时,C的百分含量在增加,说明反应正在向正反应方向进行,所以V正> V逆,所以C正确。T3时C的百分含量达到最高,说明T3之前反应未达化学平衡状态,,T3之后,C的百分含量减少,说明温度升高化学平衡向逆反应方向移动,所以正反应为放热反应,D正确。

练习册系列答案
相关题目

