题目内容
【题目】Ⅰ、甲醇既是重要的化工原料,又可作为燃料,利用CO和H2在催化剂作用下可合成甲醇(g)。
(1)已知相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
合成甲醇(g)的热化学方程式为______________________________________________。
(2)500K、101KPa条件下,反应过程中测得n(CO)、n(H2)、n(CH3OH)随时间t变化的关系如图甲所示。现保持其它条件不变,起始只改变温度,在改变的这个温度下反应至t1时刻,此时n(H2)比图象中的值大,那么该温度可能是________。
A、700K B、373K C、以上均不对
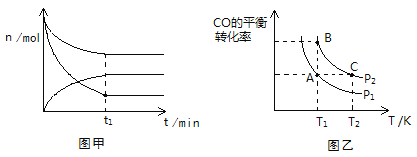
(3)在一容积可变的密闭容器中充入1 mol CO和2 mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)和压强(P)的变化曲线如图乙所示。P1、P2的大小关系为________;A、B、C三点的平衡常数(K)大小关系为______________________。
Ⅱ、可逆反应:①X(g)+2Y(g)![]() 2Z(g);②2M(g)
2Z(g);②2M(g)![]() N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
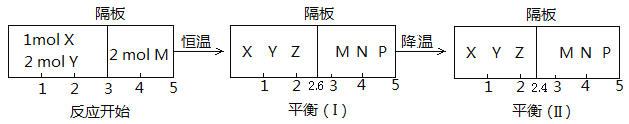
(4)反应①的正反应ΔH______0(填“>”或“<”)。
(5)反应开始时体系的压强与达平衡(Ⅰ)时体系的压强之比为_________(用分数表示)。
(6)在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数(Ⅰ)______(Ⅱ)。
A、大于 B、小于 C、等于 D、无法确定
【答案】 CO(g)+2H2(g) ![]() CH3OH(g) △H= —99kJ/mol AB P2>P1 KA=KB>KC < 6/5 D
CH3OH(g) △H= —99kJ/mol AB P2>P1 KA=KB>KC < 6/5 D
【解析】I. (1). 根据题意可知,利用CO和H2在催化剂作用下合成甲醇(g)的化学方程式为:CO(g)+2H2(g) ![]() CH3OH(g),反应热=反应物的键能总和-生成物的键能总和,则△H=(1076+2×436)kJ/mol-(3×413+343+465)kJ/mol=-99kJ/mol,故答案为:CO(g)+2H2(g)
CH3OH(g),反应热=反应物的键能总和-生成物的键能总和,则△H=(1076+2×436)kJ/mol-(3×413+343+465)kJ/mol=-99kJ/mol,故答案为:CO(g)+2H2(g) ![]() CH3OH(g) △H=-99kJ/mol;
CH3OH(g) △H=-99kJ/mol;
(2). 保持其它条件不变,起始只改变温度,在改变的这个温度下反应至t1时刻,n(H2)比图象中的值大,反应CO(g)+2H2(g) ![]() CH3OH(g) △H=-99kJ/mol为放热反应,若温度高于500K,升高温度平衡逆向移动,n(H2)比图象中的值大,若温度低于500K,反应速率减慢,则t1时刻尚未达到平衡状态,n(H2)也比图象中的值大,故答案选:AB;
CH3OH(g) △H=-99kJ/mol为放热反应,若温度高于500K,升高温度平衡逆向移动,n(H2)比图象中的值大,若温度低于500K,反应速率减慢,则t1时刻尚未达到平衡状态,n(H2)也比图象中的值大,故答案选:AB;
(3). CO(g)+2H2(g) ![]() CH3OH(g)为气体体积减少的反应,增大压强平衡正向移动,CO的转化率升高,因P2条件下CO的转化率大于P1条件下CO的转化率,所以P2>P1,CO(g)+2H2(g)
CH3OH(g)为气体体积减少的反应,增大压强平衡正向移动,CO的转化率升高,因P2条件下CO的转化率大于P1条件下CO的转化率,所以P2>P1,CO(g)+2H2(g) ![]() CH3OH(g)为放热反应,升高温度平衡逆向移动,CO的转化率降低,因T2条件下CO的转化率小于T1条件下CO的转化率,则T2>T1,又因温度相同时平衡常数相等,则A、B、C三点的平衡常数(K)大小关系为:KA=KB>KC,故答案为:P2>P1;KA=KB>KC;
CH3OH(g)为放热反应,升高温度平衡逆向移动,CO的转化率降低,因T2条件下CO的转化率小于T1条件下CO的转化率,则T2>T1,又因温度相同时平衡常数相等,则A、B、C三点的平衡常数(K)大小关系为:KA=KB>KC,故答案为:P2>P1;KA=KB>KC;
II. (4). 据图可知,平衡(I)降低温度达到平衡(II)时,隔板由2.6处移至2.4处,左室气体的总物质的量减少,说明降低温度反应X(g)+2Y(g)![]() 2Z(g)正向移动,因降低温度平衡向放热反应方向移动,所以该反应的正反应为放热反应,△H<0,故答案为:<;
2Z(g)正向移动,因降低温度平衡向放热反应方向移动,所以该反应的正反应为放热反应,△H<0,故答案为:<;
(5). 右室进行的反应2M(g)![]() N(g)+P(g)为等体积的可逆反应,达到平衡(I)时,右室气体的总物质的量仍为2mol,因压强与气体体积成反比,则由图可以看出,反应开始时体系的压强与达平衡(Ⅰ)时体系的压强之比为:
N(g)+P(g)为等体积的可逆反应,达到平衡(I)时,右室气体的总物质的量仍为2mol,因压强与气体体积成反比,则由图可以看出,反应开始时体系的压强与达平衡(Ⅰ)时体系的压强之比为:![]() =
=![]() ,故答案为:6/5;
,故答案为:6/5;
(6). 右室中气体的总物质的量始终不变,但由于降低温度,反应2M(g)![]() N(g)+P(g)的平衡会发生移动,导致M的含量变化,所以在平衡(I)和平衡(II)中M的体积分数不相等,又因为无法确定2M(g)
N(g)+P(g)的平衡会发生移动,导致M的含量变化,所以在平衡(I)和平衡(II)中M的体积分数不相等,又因为无法确定2M(g)![]() N(g)+P(g)是放热反应还是吸热反应,所以无法确定降低温度时平衡的移动方向,因此无法判断在平衡(Ⅰ)和平衡(Ⅱ)中M的体积分数大小,故答案为:D。
N(g)+P(g)是放热反应还是吸热反应,所以无法确定降低温度时平衡的移动方向,因此无法判断在平衡(Ⅰ)和平衡(Ⅱ)中M的体积分数大小,故答案为:D。