题目内容
【题目】下列有关叙述中正确的是( )
A. 常温下,![]() 的
的![]() 与
与![]() 混合溶液中:
混合溶液中:![]()
B. NaCl溶液和![]() 溶液均显中性,两溶液中水的电离程度相同
溶液均显中性,两溶液中水的电离程度相同
C. 已知![]() 时
时![]() 溶液显碱性,则
溶液显碱性,则![]() 时的电离平衡常数
时的电离平衡常数![]()
D. ![]() 醋酸溶液加少量水稀释
醋酸溶液加少量水稀释![]() 增大
增大
【答案】A
【解析】A.常温下,pH=4的CH3COOH与CH3COONa混合溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(Na+)<c(CHCOO-),故A正确;B.NaCl溶液和CH3COONH4溶液均显中性,氯化钠溶液对水的电离无影响,而醋酸根离子、铵根离子发生水解,促进了水的电离,故B错误;C.已知![]() 时
时![]() 溶液显碱性,说明铵根离子的水解程度小于氢氰酸根离子的水解程度,则
溶液显碱性,说明铵根离子的水解程度小于氢氰酸根离子的水解程度,则![]() 时的电离平衡常数氨水大于氢氰酸,故C错误;D.醋酸中加入少量水后,醋酸的电离程度增大,则溶液中醋酸的物质的量减小,氢离子的物质的量增大,由于在同一溶液中,则
时的电离平衡常数氨水大于氢氰酸,故C错误;D.醋酸中加入少量水后,醋酸的电离程度增大,则溶液中醋酸的物质的量减小,氢离子的物质的量增大,由于在同一溶液中,则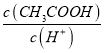 的比值减小,故D错误;故选A。
的比值减小,故D错误;故选A。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目