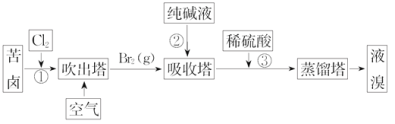
题目内容
【题目】单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:
![]()
(1)能与X发生化学反应的酸是________,由X制备Mg2Z的化学方程式为:____________。
(2)由Mg2Z生成Y的化学反应方程式为_______________,Y分子的电子式为__________。
(3)Z、X中共价键的类型分别是____________。
【答案】(1)氢氟酸;SiO2+MgO2↑+Mg2Si
(2)Mg2Si+4HCl=2MgCl2+SiH4;
(3)非极性键、极性键
【解析】试题分析:单质Z是一种常见的半导体材料,则Z为Si,X为Z的氧化物,则X为SiO2,Y为氢化物,分子结构与甲烷相似,则Y为SiH4,加热SiH4分解得到Si与氢气。(1)能与SiO2发生化学反应的酸是氢氟酸;由SiO2制备Mg2Si的化学方程式为:SiO2+4Mg![]() 2MgO+Mg2Si。
2MgO+Mg2Si。
(2)由Mg2Z生成Y的化学反应方程式为:Mg2Si+4HCl="2" MgCl2+SiH4↑,Y为SiH4,电子式为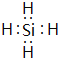 。
。
(3)Z为Si,周期表中位于第三周期IVA族,其单质属于原子晶体,化学键类型为非极性共价键;X为SiO2,属于原子晶体,含有的化学键属于极性共价键。

练习册系列答案
相关题目