��Ŀ����
����Ŀ������һ������Ԫ�أ����ijЩ������ʱ�벻������SO2�����һ����Ҫ�����Ϊ̽��SO2�����ʣ�ij��ѧ��ȤС���ͬѧ��������ϵ��ʵ�飺
��1����SO2ͨ����ɫʯ����Һ��������_________________��
��2����SO2ͨ��FeCl3��Һ�У�ʹ���ַ�Ӧ��д��SO2��FeCl3��Ӧ�����ӷ���ʽ___________________��Ϊ����֤SO2��FeCl3������������ԭ��Ӧ������Ӧ�����Һ�ֳ����ݣ����������ʵ�飺
����1������һ����Һ�м�����������KMnO4��Һ���Ϻ�ɫ��ȥ��
����2�����ڶ�����Һ�м���KSCN��Һ������죬�ټ���������ˮ����Һ��졣
����������������__________���������1������2������������
��3����SO2ͨ�뵽BaCl2��Һ�У��������쳣�����������Եİ�ɫ������Ϊ̽���ð�ɫ�����ijɷ֣��������������ʵ�����̣�

�����ٵ�����Ϊ_____���Լ�AΪ_______�������Լ�A��ɫ����δ���ܽ⣬��ð�ɫ�����ijɷ���_______���ѧʽ����
��4��Ϊ̽��SO2��Ư����SO2ֱ����������ɫ���ʻ���SO2��ˮ��Ӧ�IJ�������á������ͼװ�ý���̽����
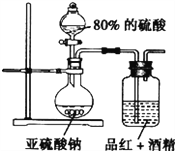
����Ϣ��ʾ��Ʒ�����ܽ��ھƾ����γɺ�ɫ��Һ��H2SO3�Ƕ�Ԫ���ᣩ
���������ƺ�Ũ���ᷴӦ�Ļ�ѧ����ʽΪ__________��
����ָ����Ƶ�װ�����������ԵIJ��㣺
___________________��________________________��
�۰����ĺ��װ�ã�ʵ���п���SO2�Խϻ���������ͨ��Ʒ��ľƾ���Һ��60���Ӻ���Һ�Բ���ɫ���ɴ˿��ƶϣ�����Ʒ����ɫ����������______________���ѧʽ����
���𰸡� ��Һ��� 2Fe3++ SO2+ 2H2O ��2Fe2++ SO42�C+ 4H+ ����2 ���� HCl BaSO4 Na2SO3+H2SO4��Ũ����Na2SO4+SO2��+H2O ��������û�и�������ȱ�ٶ�������ĸ���װ���� û��β������װ�� H2SO3��HSO3�C SO32�C
����������1��SO2����ˮ���������ᣬ��Һ�����ԣ���SO2ͨ����ɫʯ����Һ����������Һ��졣��2��SO2���л�ԭ�ԣ�SO2��FeCl3��Ӧ�����ӷ���ʽΪ2Fe3++ SO2+ 2H2O��2Fe2++ SO42�C+ 4H+��������Һ�е�������Ҳ�ܱ����Ը��������Һ��������ɫ�����Է���1�����������ڶ�����Һ�м���KSCN��Һ������죬˵�������������ӣ��ټ���������ˮ����Һ��죬˵����Һ�д����������ӡ�������ȷ����3��������Һ�еõ������IJ����ǹ��ˡ����ڰ�ɫ����ֻ�������ᱵ�������ᱵ�����Լ�AΪ��������Լ�A��ɫ����δ���ܽ⣬��˵���ð�ɫ�����ijɷ������ᱵ����4�����������ƺ�Ũ���ᷢ�����ֽⷴӦ�Ļ�ѧ����ʽΪNa2SO3+H2SO4��Ũ����Na2SO4+SO2��+H2O���ڷ���װ���Ʊ��Ķ��������к���ˮ������Ϊ̽��SO2��Ư����SO2ֱ����������ɫ���ʣ�����SO2��ˮ��Ӧ�IJ�������ã�Ӧ������������и��ͼ��ʵ��װ��ȱ�ٶ�������ĸ���װ�ã����������ж���ֱ���ŷ��ܹ����������Ⱦ����Ҫ����β��������ͼ��װ��ȱ��β������װ�ã��۰����ĺ��װ�ã�ʵ���п���SO2�Խϻ���������ͨ��Ʒ��ľƾ���Һ��60���Ӻ���Һ�Բ���ɫ���ɴ˿��ƶϣ�����Ʒ����ɫ��������SO2��������H2SO3��HSO3�C ��SO32�C�ȡ�

 ��У����ϵ�д�
��У����ϵ�д�
