题目内容
【题目】在T℃下,向装有5mL0.005mol.L-1FeCl3溶液的试管中加入5mL0.01mol·L-1KSCN溶液,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,溶液呈血红色。下列叙述正确的是( )
Fe(SCN)3+3KCl,溶液呈血红色。下列叙述正确的是( )
A.升高温度,逆反应速率减小
B.加入Fe2(SO4)3固体,溶液血红色加深
C.加入KCl固体,溶液血红色加深
D.增大压强,溶液血红色加深
【答案】B
【解析】
A.升高温度,分子能量增加,活化分子百分数增加,有效碰撞几率增大,化学反应速率增大,A错误;
B.加入Fe2(SO4)3固体,Fe3+浓度增加,平衡正向移动,红色加深,B正确;
C.KCl在溶液中电离出K+和Cl-,但这两种离子并没有参与平衡过程,因此不影响平衡移动,颜色不变,C错误;
D.该平衡存在溶液中,增大压强,溶液体积几乎不变,各物质的浓度不变,平衡不移动,颜色不变,D错误。
答案选B。

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】下列事实与原因对应关系不正确的是
A | B | C | D | |
物质 |
Na2FeO4 |
海水稻 |
金属铜 |
碳酸钠 |
事实 | 用于自来水净水消毒 | 海水稻的秸杆可以燃烧发电 | Cu作原电池的电极 | 制革工业中原料皮的脱脂 |
主要原因 | Na2FeO4有强氧化性且能在水中产生胶体 | 稻子的秸杆中蕴含生物质能 | Cu能导电且质稳定 | Na2CO3稳定性强 |
A.AB.BC.CD.D
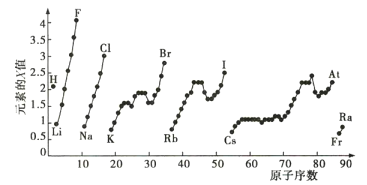
【题目】已知元素的电负性和原子半径一样,也是元素的基本性质。下表给出14种元素的电负性:
元素 | AL | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
试结合元素周期律相关知识完成下列问题。
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是__________ (从电负性与结构的关系考虑)。
(2)请预测Br与I元素电负性的大小关系:_________ 。
(3)经验规律告诉我们:当成键的两原子相应元素的电负性差值大于1.7时,一般为离子键,而小于1.7时,一般为共价键。试推断![]() 中化学键的类型是 ___________
中化学键的类型是 ___________
(4)预测元素周期表中电负性最小的元素是_____ (放射性元素除外)。