��Ŀ����
�ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
��1�������ϱ����ݿ�֪�÷�ӦΪ���ȷ�Ӧ�������� ��
�� �����ϣ�Ϊ������ƽ��ʱH2��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��������ţ�
a������ѹǿ b��ʹ�ú��ʵĴ���
c�������¶� d����ʱ����������е�NH3
��2��ԭ����H2��ͨ����Ӧ CH4(g) + H2O (g) CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е� 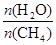 �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��
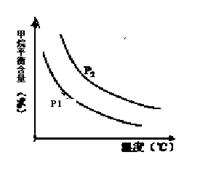
��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1 P2���>������=����<������
�ڸ÷�ӦΪ ��Ӧ������ȡ����ȡ�����
��3��ԭ����H2����ͨ����ӦCO(g) + H2O(g) CO2 (g) + H2(g) ��ȡ��
CO2 (g) + H2(g) ��ȡ��
��T ��ʱ�����ݻ��̶�Ϊ5 L�������г���1 molˮ������1 mol CO����Ӧ��ƽ����CO��Ũ��Ϊ0��08 mol��L-1����ƽ��ʱCO��ת����Ϊ �����¶��·�Ӧ��ƽ�ⳣ��KֵΪ ��
�ڱ����¶���ΪT �棬�ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬���� ������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n (CO) : n (H2O) : n (CO2) : n (H2)��1 : 16 : 6 : 6
| �� �ȣ��棩 | 360 | 440 | 520 |
| Kֵ | 0��036 | 0��010 | 0��0038 |
��1�������ϱ����ݿ�֪�÷�ӦΪ���ȷ�Ӧ�������� ��
�� �����ϣ�Ϊ������ƽ��ʱH2��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��������ţ�
a������ѹǿ b��ʹ�ú��ʵĴ���
c�������¶� d����ʱ����������е�NH3
��2��ԭ����H2��ͨ����Ӧ CH4(g) + H2O (g)
 CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е� 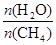 �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��
��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1 P2���>������=����<������
�ڸ÷�ӦΪ ��Ӧ������ȡ����ȡ�����
��3��ԭ����H2����ͨ����ӦCO(g) + H2O(g)
 CO2 (g) + H2(g) ��ȡ��
CO2 (g) + H2(g) ��ȡ����T ��ʱ�����ݻ��̶�Ϊ5 L�������г���1 molˮ������1 mol CO����Ӧ��ƽ����CO��Ũ��Ϊ0��08 mol��L-1����ƽ��ʱCO��ת����Ϊ �����¶��·�Ӧ��ƽ�ⳣ��KֵΪ ��
�ڱ����¶���ΪT �棬�ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬���� ������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n (CO) : n (H2O) : n (CO2) : n (H2)��1 : 16 : 6 : 6
��1�������¶����ߣ���Ӧ��ƽ�ⳣ��K��С ��a��d
��2���� < ������
��3���� 60 % ��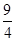 ��2��25 �� c��d
��2��25 �� c��d
��2���� < ������
��3���� 60 % ��
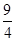 ��2��25 �� c��d
��2��25 �� c��d���������
��1���ٹ۲��������¶ȵ�����K��С����֪�÷�ӦΪ���ȷ�Ӧ��������ƽ��ʱH2��ת���ʣ��ı�������ƽ�������ƶ������Լ�ѹ�����£�����N2��Ũ�ȣ���С������Ũ�ȣ����Դ�a��d���ԡ�
��2������ͼ���֪���㶨�¶�ʱ�� P2���Ӧ��CH4��������P1�㣬���ɷ�Ӧ���ص㣬CH4(g) + H2O (g)
 CO(g) + 3H2(g)�����������������ѹǿԽ��CH4����Խ�ߣ����ԣ�P1<P2���ں㶨ѹǿʱ���¶�Խ�ߣ�CH4����Խ�ͣ��÷�ӦΪ���ȷ�Ӧ��
CO(g) + 3H2(g)�����������������ѹǿԽ��CH4����Խ�ߣ����ԣ�P1<P2���ں㶨ѹǿʱ���¶�Խ�ߣ�CH4����Խ�ͣ��÷�ӦΪ���ȷ�Ӧ����3����CO����ʼŨ��Ϊ0��2 mol��L-1��?c=0��2 mol��L-1-0��08 mol��L-1=0��012 mol��L-1������CO��ת����Ϊ0��012/0��2=0��6�� �÷�Ӧ�ĸ����ʵ�ƽ��Ũ��Ϊ[CO]= [H2O]=0��08 mol��L-1; [CO2] ="[" H2]=0��12 mol��L-1,����K=0��12��0��12/0��08��0��08=9/4=2��25��
�ڶ��ڸ÷�Ӧ����������ѹǿ�����������ܶ�ʼ�ղ���ʱ��ı䣬ab����
c����λʱ��������a mol CO2��ͬʱ����a mol H2������v��=v�棬��ȷ��d���ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ���n (CO) : n (H2O) : n (CO2) : n (H2)��1 : 16 : 6 : 6ʱ��Q=K�ﵽƽ��״̬��

��ϰ��ϵ�д�
�����Ŀ
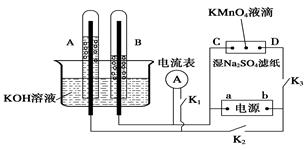
 CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)����ش��������⣺
CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)����ش��������⣺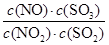 ���ﵽƽ��״̬ʱ����������¶�(������������)����Kֵ��С������˵����ȷ����( )
���ﵽƽ��״̬ʱ����������¶�(������������)����Kֵ��С������˵����ȷ����( ) NO(g)+SO3(g) ��H>0
NO(g)+SO3(g) ��H>0 2SO3�ﵽһ���Ⱥ�ͨ��18O2,һ��ʱ��18O���ܴ����ڣ� ��
2SO3�ﵽһ���Ⱥ�ͨ��18O2,һ��ʱ��18O���ܴ����ڣ� �� ���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ�����ͼ����ʾ��
���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ�����ͼ����ʾ��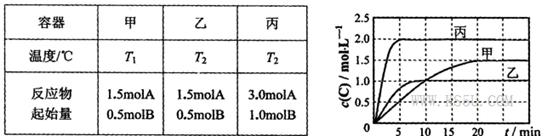
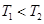 ���Ҹ÷�ӦΪ���ȷ�Ӧ
���Ҹ÷�ӦΪ���ȷ�Ӧ ���£�����ʼʱ��������г���0.5molA��1.5molB��ƽ��ʱA��ת����Ϊ25%
���£�����ʼʱ��������г���0.5molA��1.5molB��ƽ��ʱA��ת����Ϊ25% 2C(g) ��H=��QkJ/mol���мס��������ݻ���ͬ�Ҳ�����ܱ���������������м���1 mol A��3 mol B����һ�������´ﵽƽ��ʱ�ų�����ΪQ1kJ������ͬ�������£����������м���2 mol C�ﵽƽ�����������ΪQ2 kJ����֪Q1=3Q2��������������ȷ���ǣ� ��
2C(g) ��H=��QkJ/mol���мס��������ݻ���ͬ�Ҳ�����ܱ���������������м���1 mol A��3 mol B����һ�������´ﵽƽ��ʱ�ų�����ΪQ1kJ������ͬ�������£����������м���2 mol C�ﵽƽ�����������ΪQ2 kJ����֪Q1=3Q2��������������ȷ���ǣ� �� XC(g)+D(S)�������ͨ��6molA��2molB��������ͨ��1.5molA��0.5molB��3molC��2molD����Ӧһ��ʱ��ﵽƽ�⣬��ʱ��ļס������������е�C�������������0.2��������������ȷ���ǣ�
XC(g)+D(S)�������ͨ��6molA��2molB��������ͨ��1.5molA��0.5molB��3molC��2molD����Ӧһ��ʱ��ﵽƽ�⣬��ʱ��ļס������������е�C�������������0.2��������������ȷ���ǣ� 2NH3(g)����H����92.4 kJ/mol���ﵽƽ��ʱ���ų�����46.2 kJ����
2NH3(g)����H����92.4 kJ/mol���ﵽƽ��ʱ���ų�����46.2 kJ����