题目内容
(6分)如图所示,600K时,在容积可变的透明容器内,反应2HI(气) I2(气)+H2(气)达到平衡状态A。保持温度不变,将容器的容积压缩成为原容积的一半,达到平衡状态B。按图示观察方向__▲__(填“能”或“不能”)看出两次平衡时容器内颜色深浅的变化,理由是_▲__。若从水平方向观察,能否看到容器内颜色深浅的变化__▲___。
I2(气)+H2(气)达到平衡状态A。保持温度不变,将容器的容积压缩成为原容积的一半,达到平衡状态B。按图示观察方向__▲__(填“能”或“不能”)看出两次平衡时容器内颜色深浅的变化,理由是_▲__。若从水平方向观察,能否看到容器内颜色深浅的变化__▲___。
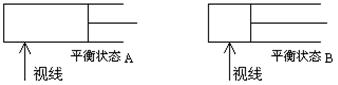
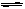 I2(气)+H2(气)达到平衡状态A。保持温度不变,将容器的容积压缩成为原容积的一半,达到平衡状态B。按图示观察方向__▲__(填“能”或“不能”)看出两次平衡时容器内颜色深浅的变化,理由是_▲__。若从水平方向观察,能否看到容器内颜色深浅的变化__▲___。
I2(气)+H2(气)达到平衡状态A。保持温度不变,将容器的容积压缩成为原容积的一半,达到平衡状态B。按图示观察方向__▲__(填“能”或“不能”)看出两次平衡时容器内颜色深浅的变化,理由是_▲__。若从水平方向观察,能否看到容器内颜色深浅的变化__▲___。

略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Fe(s)+CO2(g) △H>0
Fe(s)+CO2(g) △H>0 及时移出
及时移出 Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为 ▲ 。(精确到0.1%)
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为 ▲ 。(精确到0.1%) CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸汽浓度,平衡向 反应方向移动(填“正”、“逆”或“不”下同),CO的浓度将 。(填“增大”、“减小”或“不变”下同)
CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸汽浓度,平衡向 反应方向移动(填“正”、“逆”或“不”下同),CO的浓度将 。(填“增大”、“减小”或“不变”下同) N2O4(g) 当活塞迅速向外拉时,平衡向 反应方向移动,气体的颜色先变_____(“浅”、“深”或“不变”下同),后变______;最终和最初相比,_____更深(填“前”或“后”)。
N2O4(g) 当活塞迅速向外拉时,平衡向 反应方向移动,气体的颜色先变_____(“浅”、“深”或“不变”下同),后变______;最终和最初相比,_____更深(填“前”或“后”)。 : 起始时加入的N2、H2、NH3均为2mol,5min后反应达到平衡, NH3的物质的量为3mol,求:
: 起始时加入的N2、H2、NH3均为2mol,5min后反应达到平衡, NH3的物质的量为3mol,求: x C(g) + 2D(g) , 经5s反应达平衡,在此5s内C的平均反应
x C(g) + 2D(g) , 经5s反应达平衡,在此5s内C的平均反应 2SO3(g),已知c始(SO2)=0.4mol/L,c始(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19。判断:当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?(要求写出计算过程)
2SO3(g),已知c始(SO2)=0.4mol/L,c始(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19。判断:当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?(要求写出计算过程) 2C(g),下列说法属于该反应达到平衡标志的是( )
2C(g),下列说法属于该反应达到平衡标志的是( ) 达到平衡时,下列说法中正确的是( )
达到平衡时,下列说法中正确的是( ) 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是