题目内容
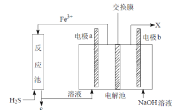
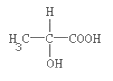
【题目】葡萄糖酸亚铁(C6H11O7) 2Fe是常用的补铁剂,易溶于水。用下图装置制备 FeCO3,提取出的 FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。回答下列问题:

Ⅰ.(1)如何检验 A 装置的气密性?____。
(2)B中加入药品Na2CO3,要使A中制得的FeSO4溶液进入B中发生反应,实验开始时,应打开分液漏斗的活塞、______,关闭_____,一段时间后,关闭_______,打开_____(填旋塞的编号)。
(3)将制得的碳酸亚铁悬浊液过滤、洗涤。如何证明沉淀已经洗涤干净_________。
(4)将葡萄糖酸与碳酸亚铁混合,反应的化学方程式为(有机物用分子式表示)_____。
(5)从环境保护的角度分析,该装置存在不足之处,请写出改正措施__________。
Ⅱ.某补铁剂的主要成分是硫酸亚铁,用氧化还原滴定法可测定该补铁剂中铁元素的含量,实验的主要步骤如下:
①取10片补铁剂样品,溶解除去不溶物(不损耗铁元素),并配成100mL待测溶液。
②量取20.00mL待测液于锥形瓶中。
③用cmol·L1的酸性KMnO4溶液滴定至终点,记录消耗KMnO4溶液的体积,重复两次实验,平均消耗KMnO4溶液体积为VmL。
(6)上述实验中应该用稀硫酸酸化KMnO4溶液,如果用硝酸对KMnO4溶液进行酸化,对测定结果的影响是_____(填“偏大”“偏小”或“无影响”)。滴定终点的实验现象为_____。
(7)每片补铁剂含铁元素的质量为________________g(用代数式表示)。
【答案】关闭 K1、K2,打开分液漏斗的活塞,从分液漏斗上方注入水,若一段时间后,水不再滴下,且维持一段时间,则A装置的气密性良好,反之,则气密性不好 K2 K1 K2 K1 取少量最后一次洗涤液于一洁净的试管中,加入稀盐酸,无现象,再加入少量 BaCl2溶液,若无白色沉淀产生,则沉淀已经洗涤干净,反之,则未洗涤干净 2C6H12O7+FeCO3→(C6H11O7)2Fe+CO2+H2O 把尾气用酒精灯点燃 偏小 当滴入最后一滴酸性 KMnO4溶液时,溶液变为紫色,并且半分钟内不褪色,则达到滴定终点 0.14cv
【解析】
由实验装置图可知,该实验的反应为实验开始时,应打开分液漏斗的活塞、K2,关闭K1,装置A中铁屑与稀硫酸反应生成硫酸亚铁和氢气,利用反应生成的氢气将装置中的空气排尽,防止FeCO3被氧化,待空气排尽后,关闭K2,打开K1,反应生成的氢气使圆底烧瓶中压强增大,从而将A中生成的硫酸亚铁溶液压入装置B中,硫酸亚铁与碳酸钠反应生成碳酸亚铁沉淀,提取出的 FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。
(1)检验 A 装置的气密性可用液压法,具体操作为关闭 K1、K2,打开分液漏斗的活塞,从分液漏斗上方注入水形成密闭系统,若装置的气密性良好,加入水一段时间后,容器中气体压强增大,水不再滴下,且维持一段时间,故答案为:关闭 K1、K2,打开分液漏斗的活塞,从分液漏斗上方注入水,若一段时间后,水不再滴下,且维持一段时间,则A装置的气密性良好,反之,则气密性不好;
(2)B中加入药品Na2CO3,要使A中制得的FeSO4溶液进入B中发生反应,实验开始时,应打开分液漏斗的活塞、K2,关闭K1,装置A中铁屑与稀硫酸反应生成硫酸亚铁和氢气,利用反应生成的氢气将装置中的空气排尽,一段时间后,关闭K2,打开K1,反应生成的氢气使圆底烧瓶中压强增大,从而将A中生成的硫酸亚铁溶液压入装置B中,故答案为:K2;K1K2;K1;
(3)装置B中硫酸亚铁溶液与碳酸钠溶液反应生成碳酸亚铁沉淀和硫酸钠,过滤得到的碳酸亚铁表面附有可溶的硫酸钠,证明沉淀已经洗涤干净的标志是洗涤液中不含有硫酸钠,检验洗涤液中是否存在硫酸根离子可以选用酸化的氯化钡溶液,具体操作为取少量最后一次洗涤液于一洁净的试管中,加入稀盐酸,无现象,再加入少量 BaCl2溶液,若无白色沉淀产生,则沉淀已经洗涤干净,反之,则未洗涤干净,故答案为:取少量最后一次洗涤液于一洁净的试管中,加入稀盐酸,无现象,再加入少量 BaCl2溶液,若无白色沉淀产生,则沉淀已经洗涤干净,反之,则未洗涤干净;
(4)葡萄糖酸与碳酸亚铁反应生成葡萄糖酸亚铁、二氧化碳和水,反应的化学方程式为2C6H12O7+FeCO3→(C6H11O7)2Fe+CO2↑+H2O,故答案为:2C6H12O7+FeCO3→(C6H11O7)2Fe+CO2↑+H2O;
(5)从环境保护的角度来看,实验过程中的氢气没有处理,应选用气球收集或用酒精灯点燃处理氢气,故答案为:用酒精灯点燃;
(6)硝酸具有强氧化性,能将亚铁离子氧化,如果用硝酸对KMnO4溶液进行酸化,硝酸会氧化亚铁离子,导致与亚铁离子反应的酸性高锰酸钾的体积偏小,所测结果偏低;当溶液中的亚铁离子被完全氧化后,若再滴入酸性高锰酸钾溶液,溶液会变为紫色,故答案为:偏小;当滴入最后一滴酸性 KMnO4溶液时,溶液变为紫色,并且半分钟内不褪色,则达到滴定终点;
(7)溶液中亚铁离子与酸性高锰酸钾溶液发生氧化还原反应生成铁离子、锰离子和水,反应的离子方程式为MnO4-+ 5Fe2++8H+=Mn2++5Fe3++4H2O,反应中消耗KMnO4的物质的量为10-3cvmol,由方程式可知10片补铁剂样品中亚铁离子的物质的量为10-3cvmol×5×5=0.025 cvmol,则每片补铁剂含铁元素的质量为![]() =0.14cvg,故答案为:0.14cv。
=0.14cvg,故答案为:0.14cv。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案