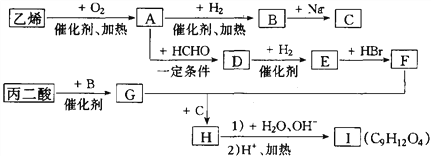
题目内容
【题目】用电石(CaC2)制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量, 从而计算电石(CaC2)的纯度。
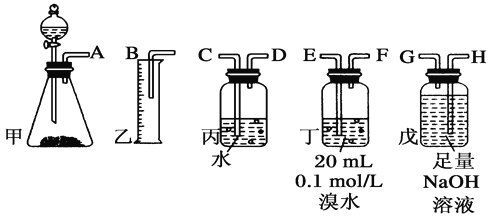
(1)完成甲装置发生的化学反应方程式______________。
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是____________________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用____________________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________________;
(5)若没有除H2S的装置,测定结果将会________(填“偏高”、“偏低”或“不变”),理由是_________________________________ (用化学方程式表示)。
【答案】 ![]() AHGEFDCB 饱和食盐水
AHGEFDCB 饱和食盐水 ![]() % 偏高 H2S+Br2===S↓+2HBr
% 偏高 H2S+Br2===S↓+2HBr
【解析】(1). 甲是制取乙炔的实验装置,电石与水反应生成乙炔和氢氧化钙,化学方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2). 电石与足量水反应生成乙炔,其中混有的H2S气体可用NaOH溶液吸收,乙炔气体被溴水吸收后余下的部分通过排水法测量其体积,所以正确的连接顺序为:AHGEFDCB,故答案为:AHGEFDCB;
(3). 实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流,故答案为:饱和食盐水;
(4). 在标准状况下溴水与乙炔完全反应生成C2H2Br4,化学方程式为:C2H2+2Br2= C2H2Br4,溴单质的物质的量为n(Br2)=0.1mol/L×0.02L=0.002mol,消耗乙炔的物质的量为:0.002mol÷2=0.001mol,测得量筒内液体体积为VmL,则与溴水反应后剩余乙炔的体积为VmL,物质的量为V×10-3L÷22.4L/mol=![]() mol,由CaC2+2H2O→Ca(OH)2+C2H2↑可知,CaC2的物质的量为(0.001+
mol,由CaC2+2H2O→Ca(OH)2+C2H2↑可知,CaC2的物质的量为(0.001+![]() )mol,质量为(0.001+
)mol,质量为(0.001+![]() )×64g,则电石纯度可表示为
)×64g,则电石纯度可表示为 ×100%=
×100%=![]() %,故答案为:
%,故答案为:![]() %;
%;
(5). 硫化氢具有还原性,能与溴发生氧化还原反应,导致测得乙炔的物质的量偏多,最终测得电石的纯度偏高,硫化氢和溴反应生成溴化氢和单质硫,化学方程式为:H2S+Br2=S↓+2HBr,故答案为:偏高;H2S+Br2=S↓+2HBr。

【题目】已知CO是工业上重要的原料,可作燃料、冶炼金属、合成液体酒精等。
(1)研究表明:反应CO(g)+H2O(g) ![]() H2(g)+CO2(g) ⊿H = ?
H2(g)+CO2(g) ⊿H = ?
平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
Ⅰ.通过平衡常数随温度的变化情况,推断反应热⊿H________ 0 (填>、<、﹦ )
Ⅱ.若反应在500℃时进行,设起始的CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为________。
(2)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D 均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

①甲中通入CO的电极为______(填“正”、“负”、“阴”、“阳”)极,该电极反应方程式为__________。
②若乙中A极析出的气体在标准状况下的体积为2.24L,此时要使乙中CuSO4溶液恢复到原来的浓度,需要加入的物质及其物质的量是(___________)。
A.0.1molCuO B.0.1molCu(OH)2 C.0.1molCu2(OH)2CO3
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示。完成丙装置C、D电极反应式:C:____________________________;D:________________________________;丙装置溶液中 c(Cl-)= _______________ mol/L 。