题目内容
【题目】(11分)运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g)![]() 2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如图所示,根据图回答下列问题:
2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如图所示,根据图回答下列问题:
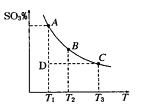
①2SO2(g)+O2(g)![]() 2SO3(g)的△H________0(填“>”或“<”),
2SO3(g)的△H________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是________。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
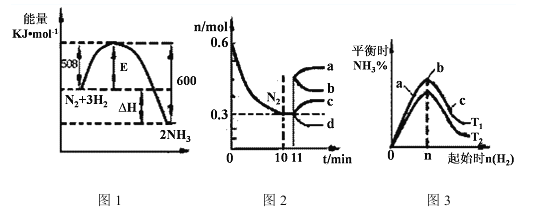
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
【答案】(1)①< ②b、e
(2)①![]() 减小 ②0.045mol/(L·min) d ③c <
减小 ②0.045mol/(L·min) d ③c <
【解析】
试题分析:(1)①根据图像可知,随温度升高,三氧化硫的含量降低,说明升高温度,平衡逆向移动,所以正向是放热反应,△H <0;
②a、该装置为一体积不变的密闭容器,气体的总质量不变,则气体的密度始终不变,所以体系的密度不发生变化的状态不一定是平衡状态,错误;b、平衡时,各物质的含量保持不变,则二氧化硫与三氧化硫的体积比保持不变,正确;c、根据元素守恒,S元素的质量始终不变,则S元素的质量分数始终不变,不能判断为平衡状态,错误;d、单位时间内转移4 mol 电子,说明有2mol的二氧化硫或三氧化硫消耗或生成,不能判断反应的方向,所以不能判断平衡状态,错误;e、因为该反应是气体的分子数发生变化的可逆反应,所以容器内的气体分子总数不再变化的状态为平衡状态,正确,答案选be;
(2)①根据平衡常数的定义,可知合成氨反应的平衡常数为![]() ;根据图1可知该反应是放热反应,所以温度升高,平衡逆向移动,则平衡常数减小 ;
;根据图1可知该反应是放热反应,所以温度升高,平衡逆向移动,则平衡常数减小 ;
②由图2信息, 0~10min内氮气的物质的量减少0.6mol-0.3mol=0.3mol,则氢气的物质的量应减少0.9mol,则该反应的平均速率v(H2)=0.9mol/2L/10min=0.045mol/(L·min) ;压缩容器的体积为1L时,压强增大,则平衡正向移动,氮气的物质的量减少,所以选择d曲线;
③增大氢气的物质的量,则平衡会正向移动,氮气的转化率增大,a、b、c三点比较,c点氢气的物质的量最大,所以c点氮气的转化率最大;当氢气的物质的量不变时,温度从T1变为T2时,氨气的含量减少,说明平衡逆向移动,逆向为吸热反应,所以从T1变为T2为升高温度,T1 <T2。