题目内容
【题目】运用化学反应原理知识回答下列有关碳和碳的化合物的问題
⑴汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(己知该反应在一定条件下可以自发进行)。在2L密闭容器中加入一定量NO和CO,当溫度分别在T1和T2时,测得各物质平衡时物质的量如下表:
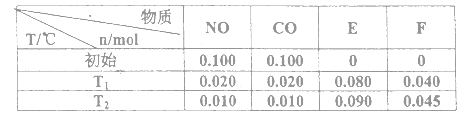
①请结合上表数据,写出NO与CO反应的化学方程式___________________,该反应的△S_______0 (填“<”或“>”)。
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。根据表中数据计算K1=_________,根据表中数据判断,温度T1和T2关系是(填序号)______________。
A. T1>T2 B. T1<T2 C.无法比较
(2)生成的CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200mL3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为____________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为:___________mol/L。(忽略混合前后溶液体积的变化)
(4)己知14gCO完全燃烧时放出141.5 kJ 的热量,则写出CO燃烧热的热化学方程式:_____________。
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极:_________;正极:________
【答案】 2CO+ 2NO![]() N2+2CO2 < 3200 A c(Na+)>c(HCO3-)>c(CO32_)>c(OH-)>c(H+) 5.6×10-5 CO(g) + 1/2O2(g)
N2+2CO2 < 3200 A c(Na+)>c(HCO3-)>c(CO32_)>c(OH-)>c(H+) 5.6×10-5 CO(g) + 1/2O2(g)![]() CO2(g) △H=-283 kJ/mol 2CO-4e-+2CO32- =4CO2 O2+ 4e-+2CO2=2CO32-
CO2(g) △H=-283 kJ/mol 2CO-4e-+2CO32- =4CO2 O2+ 4e-+2CO2=2CO32-
【解析】(1)①由表中数据可知,CO、NO、E、F的化学计量数之比为0.08:0.08:0.08:0.04=2:2:2:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:2CO+2NO2CO2+N2;反应后气体的物质的量减少,△S<0,故答案为:2CO+2NO2CO2+N2;<;
②从表中数据可知T1℃时的平衡浓度c(CO)=(NO)= ![]() =0.01mol/L,c(N2)=
=0.01mol/L,c(N2)= ![]() =0.02mol/L,c(CO2)=
=0.02mol/L,c(CO2)= ![]() =0.04mol/L,故T1℃时该反应的平衡常数为K1=
=0.04mol/L,故T1℃时该反应的平衡常数为K1=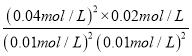 =3200;表中数据可知,温度由T1变为T2,平衡向正反应移动,由于正反应是放热反应,说明T1>T2;故答案为:3200;A;
=3200;表中数据可知,温度由T1变为T2,平衡向正反应移动,由于正反应是放热反应,说明T1>T2;故答案为:3200;A;
(2)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物;混合物显碱性c(OH-)>c(H+),碳酸根离子水解程度大与碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=![]() ×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=
×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=![]() mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L,故答案为:5.6×10-5;
mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L,故答案为:5.6×10-5;
(4)14gCO的物质的量为![]() =0.5mol,完全燃烧时放出141.5 kJ 的热量,则1molCO完全燃烧放出283 kJ 的热量, CO燃烧热的热化学方程式为CO(g) + 1/2O2(g)=CO2(g) △H=-283 kJ/mol,故答案为:CO(g) + 1/2O2(g)=CO2(g) △H=-283 kJ/mol;
=0.5mol,完全燃烧时放出141.5 kJ 的热量,则1molCO完全燃烧放出283 kJ 的热量, CO燃烧热的热化学方程式为CO(g) + 1/2O2(g)=CO2(g) △H=-283 kJ/mol,故答案为:CO(g) + 1/2O2(g)=CO2(g) △H=-283 kJ/mol;
(5)燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-=4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-;原电池电极反应,正极上的电极反应式为O2+4e-+2CO2=2CO32-;负极上的电极反应式为2CO-4e-+2CO32-=4CO2;故答案为:2CO-4e-+2CO32-=4CO2;O2+4e-+2CO2=2CO32-。

【题目】(15分)铁及其化合物在国民经济、日常生活中占有非常重要的地位,了解铁及其化合物的性质和用途非常重要。请回答下列问题:
(1)铁在自然界中以态存在,其氧化物呈黑色的是 ,呈红褐色的是 (填写化学式)。
(2)铁在纯氧气中燃烧的化学方程式为 。
铁在氯气中反应的产物是 。
(3)要验证一种溶液中是否含有Fe3+、Fe2+,正确的实验方法是 。
A.向甲试管中加入试液,滴入KSCN溶液,若显血红色,证明一定存在Fe3+。
B.向乙试管中加入试液,滴入氯水,若氯水褪色,证明一定存在Fe2+。
C.向丙试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中一定存在Fe3+
(4)铁合金有下列数据:
钢 | |||
碳素钢(Fe、C、Mn、Si) | 合金钢 | ||
低碳钢 | 中碳钢 | 高碳钢 | 碳素钢+Cr、Mn、W、Ni、Co等 |
含碳量<0.3% | 含碳量0.3%--0.6% | 含碳量>0.6% | |
韧性好,强度低 | 韧性好、强度好 | 硬而脆 | 具有特殊性能 |
取15g某碳素钢样品,按下列实验流程进行操作:

①A、B的作用是 ,
②充分加热完全反应后,D装置质量增加0.022g,该样品属于钢。
③没有A、B装置,实验结果(填“偏高”“偏低”“不影响”)



