��Ŀ����
����Ŀ��N2O5��һ����������������һ���¶��¿ɷ������·�Ӧ��2N2O5��g��4NO2��g��+O2��g����H��0��T1�¶�ʱ�����ܱ�������ͨ��N2O5���壬����ʵ�����ݼ��±���
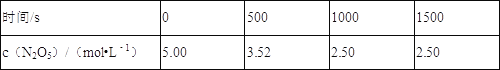
����˵����ȷ���ǣ� ��
A.500_s��NO2����������Ϊ2.96��10��3_molL��1s��1
B.T1�¶��¸÷�Ӧƽ��ʱN2O5��ת����Ϊ29.6%
C.�ﵽƽ�������������䣬�����������ѹ����ԭ��1/2����c��N2O5����5.00molL��
D.T1�¶��µ�ƽ�ⳣ��ΪK1��T2�¶��µ�ƽ�ⳣ��ΪK2����T1��T2����K1��K2
���𰸡�D
��������
A.500s��N2O5����N2O5��ʾ��ƽ������Ϊ��v��N2O5��=![]() =2.96��10-3molL-1s-1����v��NO2��=2v��N2O5��=5.92��10-3molL-1s-1����A����
=2.96��10-3molL-1s-1����v��NO2��=2v��N2O5��=5.92��10-3molL-1s-1����A����
B.���ݱ������ݿ�֪��1000sʱ�ﵽƽ��״̬����ʱN2O5��ƽ��Ũ��Ϊ2.5mol/L����T1�¶��¸÷�Ӧƽ��ʱN2O5��ת����Ϊ![]() ��100%=50%����B����
��100%=50%����B����
C.�ﵽƽ��������������䣬�����������ѹ����ԭ����1/2����ƽ�ⲻ�ƶ�����c��N2O5��=5.00mol/L����С���������ѹǿ����ƽ�����������ƶ�����N2O5��Ũ������c��N2O5��>5.00mol/L����C����
D.��Ӧ2N2O5��g��4NO2��g��+O2��g���ġ�H>0��Ϊ���ȷ�Ӧ�������¶Ⱥ����淴Ӧ���ʶ�������ƽ�����������ƶ�����D��ȷ��
�𰸣�D��

 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�